Determinación de Antígeno Prostático Específico en pacientes crónicos que asisten al Hospital de San Lorenzo, Municipio San Lorenzo, Nicaragua
Determination of Prostate Specific Antigen in chronic patients attending the San Lorenzo Hospital, San Lorenzo Municipality, Nicaragua
Denis Javier Gudiel Gudiel
Licenciado en Bioanálisis clínico, Docente UNAN-Managua, FAREM-Chontales
https://orcid.org/0000-0003-4609-3452
denisjaviergudiel@gmail.com
Eyleang Elizabeth Romero Romero
Licenciada en Bioanálisis clínico, Docente UNAN-Managua, FAREM-Chontales
https://orcid.org/0000-0002-1737-6165
romeroeyleang@gmail.com
Fátima Gabriela Gaitán Álvarez
Licenciada en Bioanálisis clínico, Egresada UNAN-Managua, FAREM-Chontales
https://orcid.org/0000-0001-6368-3185
gaitanfaty@gmail.com
Jeanetth de los Angeles Traña Tablada
Licenciada en Bioanálisis clínico, Egresada UNAN-Managua, FAREM-Chontales
https://orcid.org/0000-0002-6649-9946
angelestranatablada@gmail.com
Leydi Angélica Valdez Gómez
Licenciada en Bioanálisis clínico, Egresada UNAN-Managua, FAREM-Chontales
https://orcid.org/0000-0001-8911-7800
valdezleydi9@gmail.com
Recibido
04/02/2022
Aceptado
11/07/2022
RESUMEN
La investigación tuvo por objetivo determinar la concentración de Antígeno Prostático Específico (PSA) en pacientes crónicos que asisten al Hospital Primario “Ahmed Campos Corea” el Papayal, San Lorenzo y asociar mediante el estadístico Chi cuadrado los factores endógenos y exógenos que pueden causar alteración. El estudio tenía un enfoque cuantitativo y alcance descriptivo, prospectivo y de corte transversal. La información se obtuvo mediante encuestas aplicadas a 30 pacientes, de los cuales también se extrajo muestras sanguíneas (suero) para medir el PSA mediante el método ELISA. Los datos obtenidos se procesaron en SPSS 21 y los gráficos se extrajeron de Excel 2013. Las edades oscilaban de 50 a 79 años con una media de 63 ±10. La etnia mestiza se encontró en un 100% y los antecedentes familiares 16.7%. El alcoholismo se presentó en un 33.33%, fumado 20%, sedentarismo 53.3%, consumo de carnes grasosas 80%, IMC >30 36.7%, contacto con herbicidas y pesticidas 60% y actividad sexual activa 73.3%. Las enfermedades crónicas que padecían fueron Hipertensión en un 86.7% y Diabetes Tipo II con 6.7%. La concentración de PSA obtenida varía de 0.1 a 12.1 ng/ml, con una media de 1.52 ng/ml. Se encontró en un 10% de los pacientes en estudio alteración del PSA, relacionado en un 18.18% con los factores de riesgo asociados a neoplasia prostática. Sólo hubo dependencia de las variables entre los factores endógenos edad (X2: 20.74; VC 11.070) y antecedentes familiares (X2:6.0; VC: 3.841).
PALABRAS CLAVES
Antígeno Prostático Específico; ELISA; factor endógeno; factor exógeno; paciente crónico.
ABSTRACT
The objective of the research was to determine the concentration of Prostate Specific Antigen (PSA) in chronic patients attending the Primary Hospital "Ahmed Campos Corea" El Papayal, San Lorenzo and to associate endogenous and exogenous factors that may cause alteration by means of the Chi-square statistic. The study had a quantitative approach and a descriptive, prospective and cross-sectional scope. The information was obtained by means of surveys applied to 30 patients, from whom blood samples (serum) were also extracted to measure PSA by ELISA method. The data obtained were processed in SPSS 21 and the graphs were extracted from Excel 2013. Ages ranged from 50 to 79 years with a mean of 63 ±10. Mestizo ethnicity was found in 100% and family history 16.7%. Alcoholism was present in 33.33%, smoking 20%, sedentary lifestyle 53.3%, fatty meat consumption 80%, BMI >30 36.7%, contact with herbicides and pesticides 60% and active sexual activity 73.3%. The chronic diseases they suffered from were hypertension 86.7% and type II diabetes 6.7%. The PSA concentration obtained varied from 0.1 to 12.1 ng/ml, with a mean of 1.52 ng/ml. PSA alteration was found in 10% of the patients under study, related in 18.18% with the risk factors associated with prostatic neoplasia. There was only variable dependence between endogenous factors age (X2:: 20.74; VC 11.070) and family history (X2::6.0; VC: 3.841).
KEYWORDS
Prostate Specific Antigen; ELISA; endogenous factor; exogenous factor; chronic patient.
INTRODUCCIÓN
La próstata es un órgano fibromuscular y glandular que se encuentra apenas debajo de la vejiga. La próstata normal pesa 18 g, mide 3 cm de longitud, 4 cm de ancho y 2 cm de espesor. Es atravesada por la uretra posterior que mide 2.5 cm de largo (…) y perforada por los conductos eyaculadores, que pasan en sentido oblicuo para vaciarse a través del veru montanum en el piso de la uretra, apenas proximal al esfínter urinario externo estriado. (Gómez & Serrano, 2016, p. 17)
El antígeno prostático específico es una glicoproteína de 240 aminoácidos que se produce en el tejido prostático normal y neoplásico, y que se encuentra en grandes concentraciones en el líquido seminal. (…) El antígeno prostático específico también se encuentra en bajas concentraciones en el suero. Una pequeña porción sérica se encuentra libre, y la mayoría está ligada a las antiproteasas alfa1-antiquimotripsina y alfa2-macroglobulina. (Arguedas, 2009, p. 1)
Dentro del laboratorio el PSA se clasifica como prueba de marcador tumoral; no obstante, al haber concentraciones detectables de forma fisiológica (menor a 4 ng/ml), debe valorarse su interpretación con cautela, debido principalmente que, aunque se encuentre por encima de los rangos normales existen condiciones que no necesariamente indiquen neoplasia prostática, como son la Hiperplasia Benigna Prostática (HBP) y la Prostatitis.
El principal factor que afecta la concentración de PSA es la edad, lo cual ha llevado a los médicos a utilizar rangos específicos; sin embargo, estos a veces pueden volverse controvertidos, por lo que algunos médicos prefieren usar un solo rango para todas las edades (< 4.0 ng/ml). Para Caraguay, los valores de referencia sugeridos para interpretar los resultados de PSA por rango de edades son: “hombres de 40–49 años: 0–2.5 ng/mL, de 50–59 años: 0–3.5 ng/mL, de 60–69 años: 0-4.5 ng/mL y de 70–79 años: 0–6.5 ng/mL (2015, p.16).
La razón por la cual se solicita comúnmente la determinación de PSA en el adulto, se debe a que el médico sospecha de cáncer de próstata, muchas veces sin tomar en cuenta o valorar la posibilidad de otras patologías benignas. Una vez que el paciente es valorado clínicamente, resulta positivo a la palpación prostática y supera los niveles considerados normales de PSA, se procede a realizar ultrasonido transrectal y estudio de biopsia prostática, para confirmar o descartar el diagnóstico.
En nuestro medio el cáncer de próstata representa un problema importante de salud pública. Según la Organización Mundial de la Salud (OMS), en su informe del perfil oncológico del 2014 establece que para Nicaragua, “en un total de 448 casos que se reportaron, la tasa de mortalidad de cáncer de próstata fue de 18.0%, encontrándose relacionado principalmente con el alcoholismo (8.7%) y la obesidad (9.7%)” (2014, p.1). Por su parte en Boaco, en el sitio web oficial del SILAIS, se reportó cifras de defuncion por cáncer de próstata de “5.7% en el 2017 de un total de 88 casos y de 7.8 % de 64 casos confirmados” (2018, p.4).
Han sido diversos los estudios que se han enfocado en determinar la concentración de PSA y su relación con factores de riesgo asociados a cáncer de próstata, estando su totalidad a nivel internacional. En Nicaragua, son pocos los proyectos investigativos que se han desarrollado sobre este antígeno y ninguno se orienta a establecer relación porcentual entre los factores de riesgo, sino, que correlacionan los valores obtenidos con los resultados de biopsias de pacientes que tienen patologia prostática.
En 2015 en la cuidad de Loja, Ecuador se desarrolló una investigación sobre cuantificación de PSA y su relación con factores de riesgo. El 13% de los pacientes presentaron valores superiores a 4ng/mL; entre los factores de riesgo encontrados mediante la aplicación de una encuesta se destaca: antecedentes familiares de cáncer e hiperplasia benigna de próstata 57%, consumo de alcohol más de 3 veces al mes 100%; consumo de tabaco más de 4 veces a la semana 71%, presencia de infección de vías urinarias 71%. (Maza, 2015, p. 2)
En este mismo país, pero en la ciudad de Cuenca, se llevó a cabo un estudio similar, donde Arce & Tenesaca encontraron que el “14% presentó concentración alta de PSA, de los cuales el 33.3% correspondía a las edades de 60-70 años. Como factores de riesgo tenemos que el 23.1% poseía sobrepeso, el 20.7% sedentarismo, el 100% antecedentes familiares, el 40% tabaquismo y el 50% tenía IVU” (2015, pp. 48, 51-62).
En HEODRA, León se midió los niveles de PSA en pacientes con diagnóstico de patología prostática. El 62.9% presentó PSA >10ng/ml. Al realizar el cruce de las variables diagnóstico y valores de PSA se observó que el 94.4% de los casos diagnosticados por histología como adenocarcinoma prostático presenta valores de PSA mayores a 10 ng/ml. Seguido por los casos diagnosticados como prostatitis crónica e hiperplasia prostática benigna donde el 56.3% y el 56.2% de los casos respectivamente, tenían valores superiores a los 10 ng/ml. (Fitoria, 2012, pp. 36,39)
Otro estudio que apuntó en esta misma línea, sobre la determinación del PSA, es el que se realizó en pacientes de Urología del Hospital Antonio Lenin Fonseca, Managua. En este “el valor mínimo reportado fue de 4.1 y el máximo de 362.2 ng/mL (…). Se reportó casos positivos de Cáncer de Próstata en un 29.8% y (…) se encontró que la media de PSA en quienes desarrollaron Cáncer fue de 78.8 ng/mL (Trujillo, 2015, pp. 46-47). Es importante mencionar que no se mostró relación proporcional entre la consanguinidad I, II y II.
El presente estudio se llevó a cabo con el objetivo principal de determinar las concentraciones de PSA en pacientes crónicos que asisten al Hospital Ahmed Campos Corea, debido a que estas se correlacionan con la instauración de las patologías prostáticas antes descritas y porque se tiene como propósito de investigación relacionar los resultados obtenidos con factores endógenos y exógenos, como son el tabaquismo, alcoholismo, alimentación poco nutritiva, exposición a agroquímicos, entre otros. Es importante mencionar que también para informar a la población diana sobre los factores de riesgo exógenos que coadyuvan a desarrollar cáncer de próstata, puesto que, al tener conocimiento de estos, pueden evitarlos y así garantizar tener una mejor calidad de vida.
MATERIALES Y MÉTODOS
La investigación posee un enfoque cuantitativo y el alcance es descriptivo, prospectivo y de corte transversal. Es cuantitativo, porque tanto la formulación del problema, recolección y presentación de datos se realizó mediante enunciados, instrumentos y procesos estadísticos. Se enmarca dentro del enfoque descriptivo, puesto que se limita a especificar características determinadas de la población como son las concentraciones de PSA y los factores endógenos y exógenos asociados a alteración, prospectivo debido a que la recolección de los datos es a medida que se desarrolló el estudio y de corte transversal ya que la recogida de información fue en un periodo corto y determinado de tiempo, correspondiente de Enero a Marzo 2019.
El área de estudio es el Hospital Primario Ahmed Campos Corea, ubicado en la comarca el Papayal, perteneciente al municipio de San Lorenzo y este a la vez al departamento de Boaco. Este hospital se ubica en el km 103 carretera al Rama. La población de estudio estaba constituida por 65 pacientes con patologías crónicas que asisten al Hospital antes descrito, donde todos poseen edades mayores de 50 años y que representan al total de adultos mayores del sexo masculino. La muestra quedó conformada por 30 de estos pacientes con edades de 50 a 79 años y correspondientes al 46.2% del total de la población, porcentaje que se considera representativo a la misma.
El tipo de muestreo utilizado fue no probabilístico de tipo Intencional. Es no probabilístico debido que “la elección de los elementos [muestra] no depende de la probabilidad, sino de causas relacionadas con las características de la investigación o los propósitos del investigador. El procedimiento no es mecánico ni se basa en fórmulas de probabilidad, sino de la toma de decisiones del investigador” (Hernández, Fernández, & Baptista, 2014, p. 176). Es de tipo intencional puesto que la muestra se seleccionó según criterios de inclusión, que corresponden a características específicas relacionadas al estudio; además porque se limita a captar elementos muéstrales representativos.
Los criterios de inclusión propuestos fueron: pacientes que pertenezcan al programa de crónicos del Hospital Primario Ahmed Campos Corea, pacientes que quieran participar voluntariamente en el estudio, pacientes que hayan llenado la encuesta y firmado el consentimiento informado y pacientes que asistan el día de muestreo en las condiciones requeridas para la toma de muestra sanguínea. Fueron excluidos aquellos pacientes que no cumplieran estos criterios y que hayan sido diagnosticados y/o tratados para patología prostática recientemente.
La información fue obtenida mediante encuestas y el análisis de muestras sanguíneas, las cuales fueron utilizadas para dar respuesta al problema en estudio. Las encuestas se aplicaron a los pacientes crónicos que conforman la muestra. El instrumento contenía preguntas generales, redactadas de manera simple, para que la población pudiese entenderlas y contestar estas con facilidad. La técnica utilizada para la cuantificación del PSA, fue el análisis inmunoenzimático ligado a enzimas (ELISA) utilizando el Equipo 2MM DIAGNOSTIKO-EIA. Los datos obtenidos tanto de la encuesta como del análisis de las muestras sanguíneas (suero) se analizó en SPSS 21 y Microsoft Excel 2013. Del programa de SPSS 21, se obtuvieron las tablas descriptivas de frecuencia y de contingencia, así como los estadísticos requeridos; luego estas se introdujeron a Excel 2013, para extraer los gráficos correspondientes.
RESULTADOS Y DISCUSIÓN
Las edades estaban comprendidas entre 50 a 79 años. Se encontró una edad promedio de 63 años ± 10, siendo la más recurrente la de 50 años (16.7%; n=5). La demás frecuencias obtenidas de las edades, de manera descendente fueron: 63 y 78 años con 10% (n=3), 51,57, 62, 68 con 6.7% (n=2) y las edades restantes con 3.3%.
Gráfico 1: Edades según grupos diarios
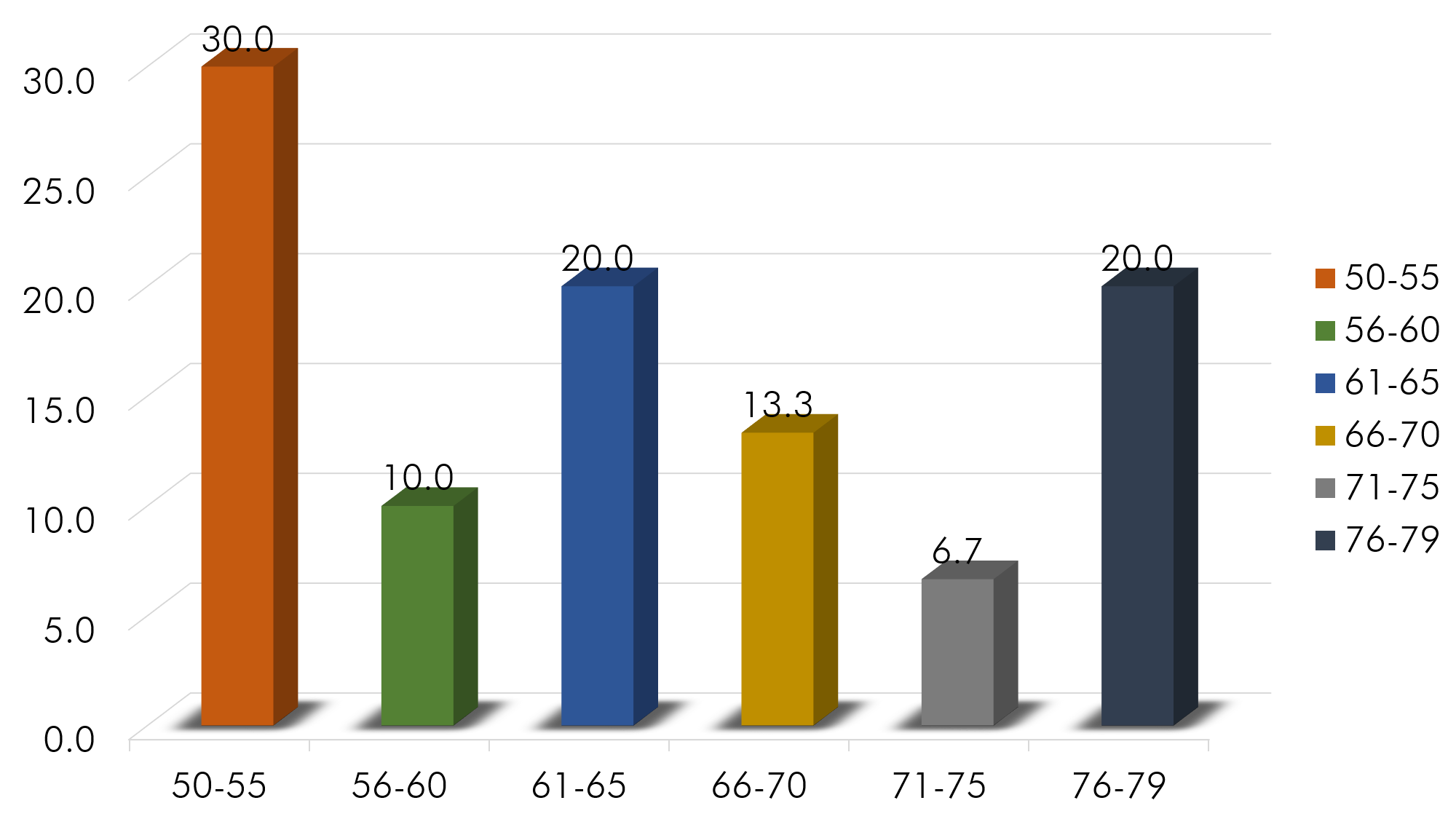
Fuente: Aplicación del instrumento
Al segmentar las edades por grupos etáreos, se obtuvo que el grupo más frecuentes fue 50-55 años (30%; n=9), seguido de 61-65 y 76-79 (20%; n=6), 56-60 (10%; n=3), 66-70 (13.3%; n=4) y 71-75 (6.7%; n=2). La distribución de edades fueron similares a las abarcadas por la mayoría de investigaciones realizadas a pacientes que se les determina la concentración de PSA, en especial las desarrolladas por Fitoria (2012) que encontró edades entre de 51 a 81 años y Trujillo (2015) con edades de 50 a 79 años. Es importante recalcar que las edades no se presentaron del todo homogéneas, concentrándose casi 1/3 de las mismas en las edades más bajas.
En su totalidad las personas que conformaron la muestra pertenecen a etnia mestiza, lo cual se explica por las características demográficas en la que está ubicada la población que es atendida en el Hospital Primario Ahmed Campos Corea y que corresponde a la Región Central del País, donde es muy poco frecuente encontrar otras etnias y lo que es más importante, que por sus costumbres por lo general no asistan a atención médica hospitalaria.
Gráfico 2. Antecedentes familiares asociados a cáncer de próstata
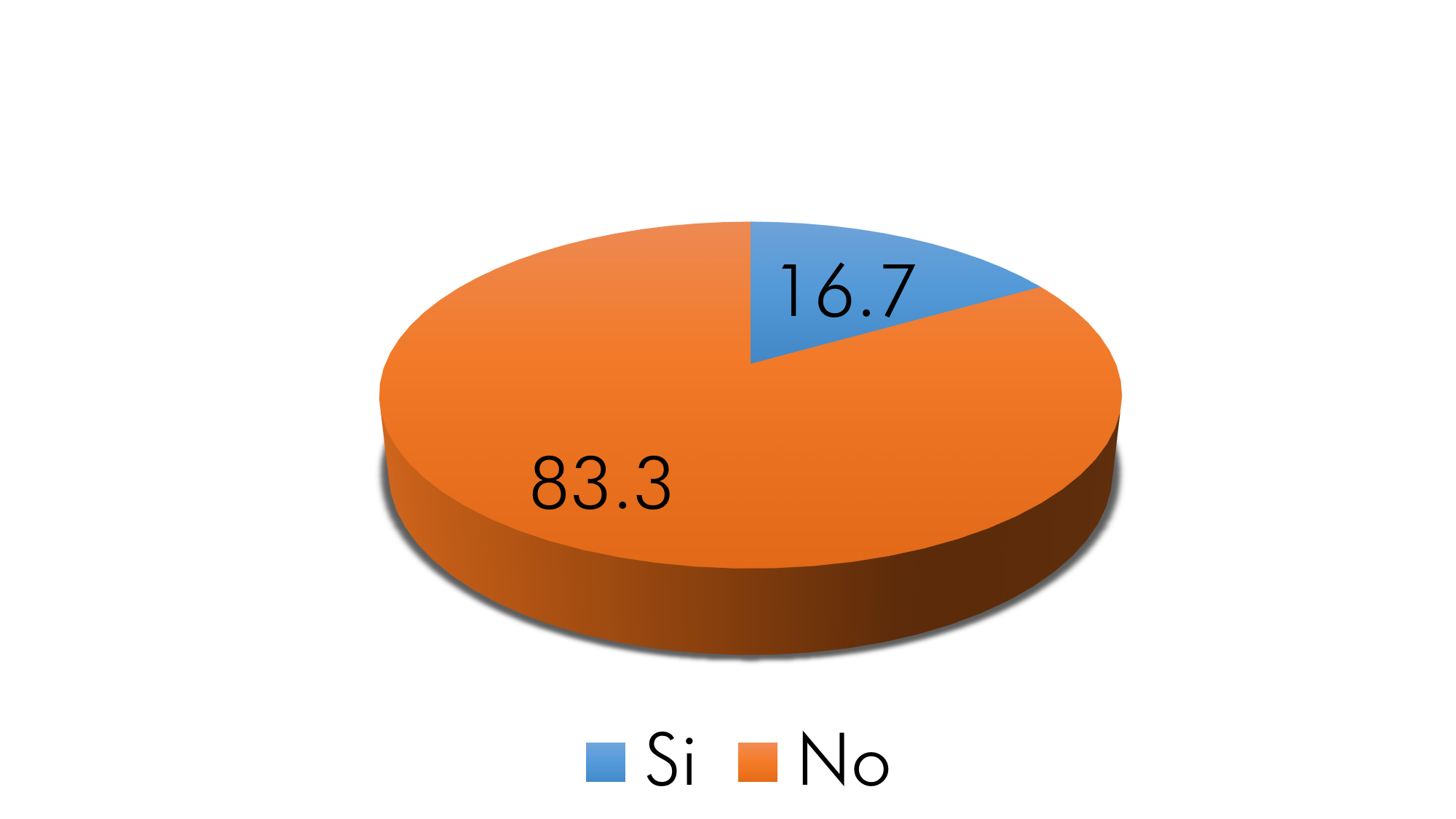
Fuente: Aplicación del instrumento
El 16.7% (n=5) de los pacientes presentó antecedentes familiares relacionados al cáncer de próstata, donde el 80% (n=4) de estos corresponden a consanguinidad II (hermano 60% y abuelo 20%) y el 20% (n=1) a consanguinidad I (papá). Lo cual se considera uno de los principales factores de riesgo para desarrollar esta patología y es el primer motivo por el cual el médico orienta chequeos rutinarios a los pacientes; cabe destacar, que el cáncer de próstata no necesariamente sigue un patrón proporcional de transmisión, ya que como describe Arce & Tenesaca solo “ de un 13 a 26% de casos siguen este patrón en los síndromes familiares de cáncer de próstata y suelen presentarse en su mayoría en pacientes menores a 70 años con más de 2 personas afectadas en la familia” (2015, pp. 27-28).
Gráfico 3. Alcoholismo
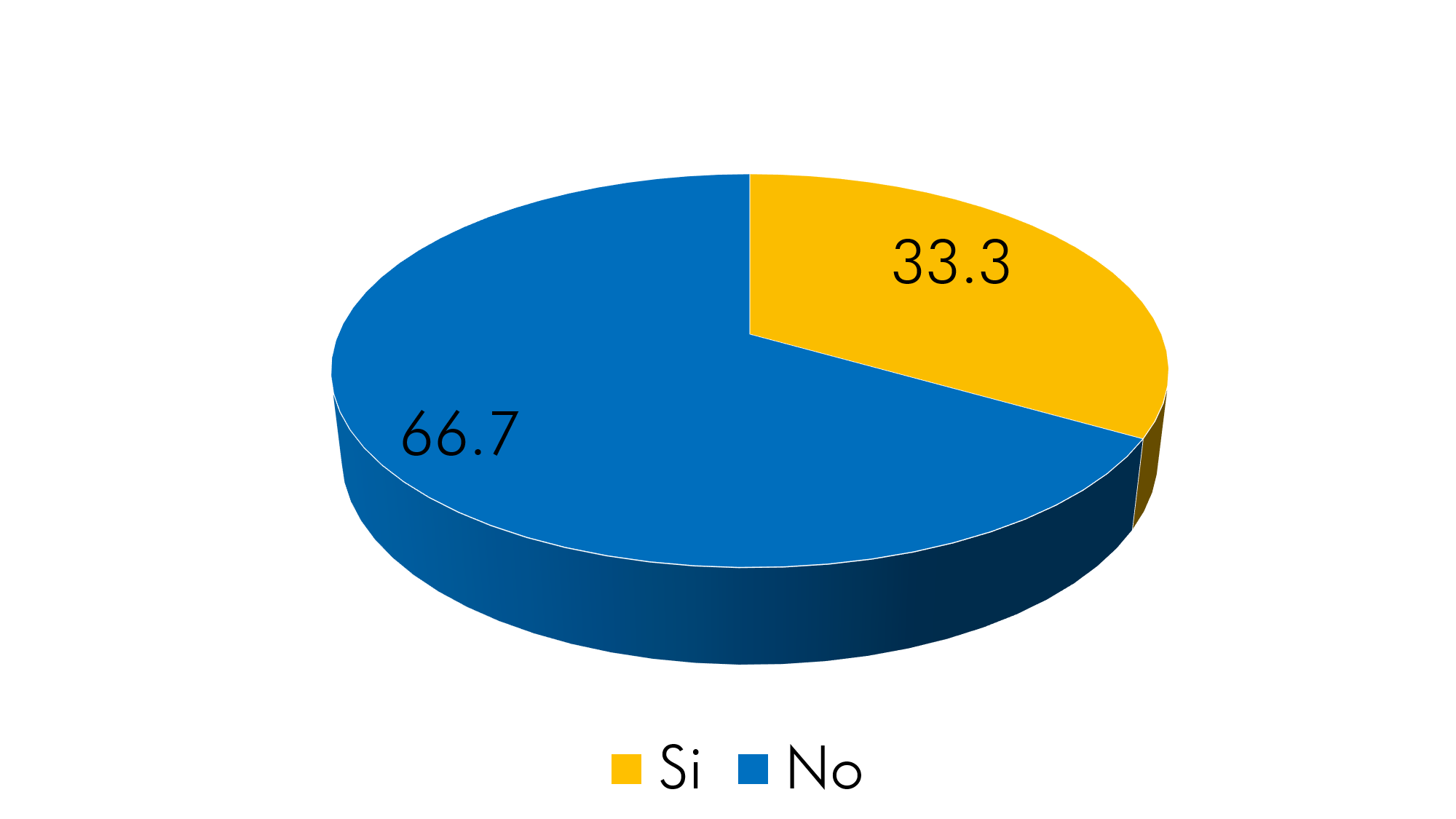
Fuente: Aplicación del instrumento
El 100% de los encuestados refirieron tomar bebidas alcohólicas en su juventud; no obstante, la mayoría de estos dejaron esta práctica con el tiempo y solo un 33.3% (n=10) continúa consumiendo este tipo de bebidas de manera frecuente, considerándolos alcohólicos activos.
Gráfico 4. Fumado
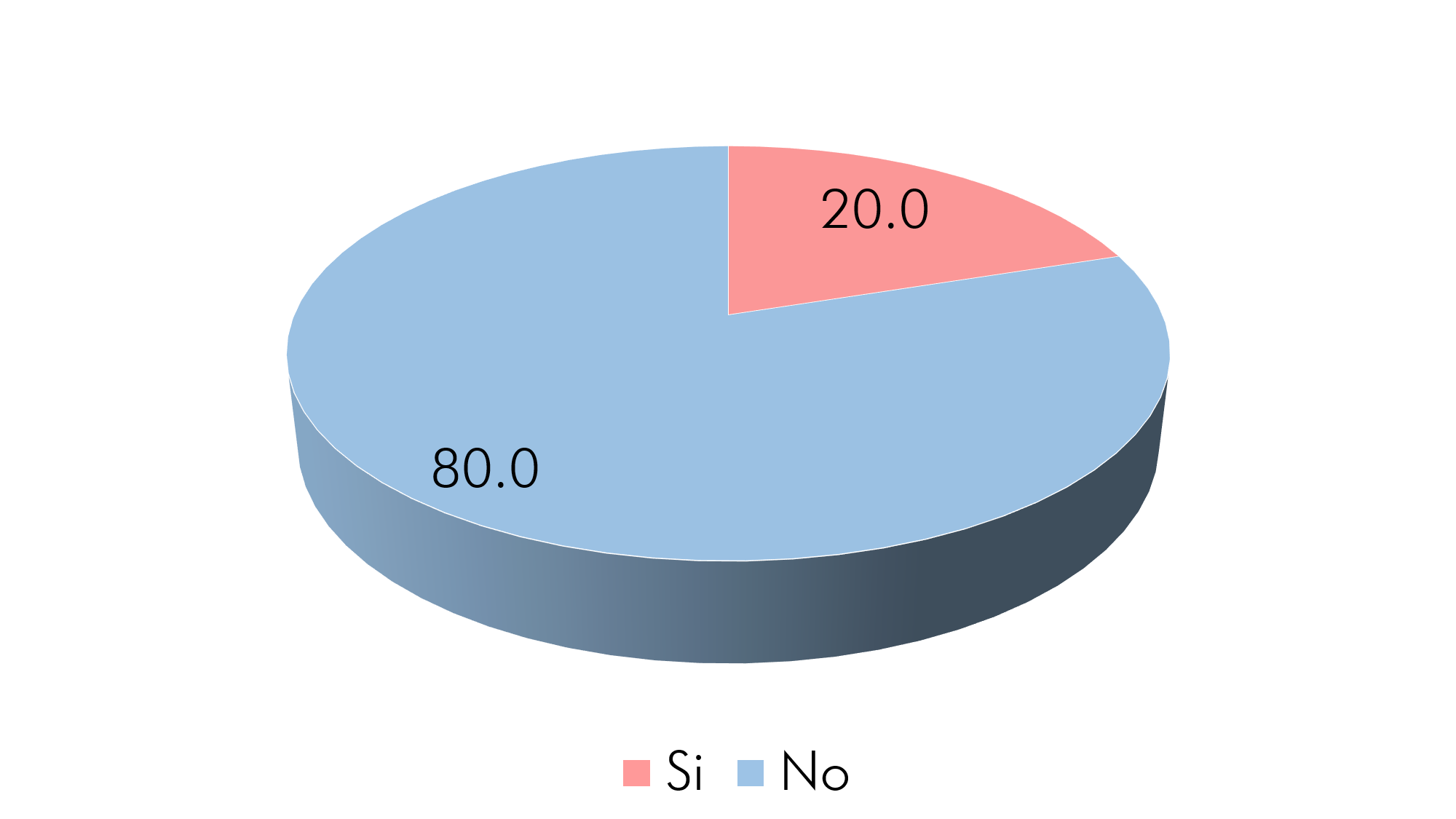
Fuente: Aplicación del instrumento
De igual manera con respecto al fumado, un 83.3% (n=25) de los pacientes fumaban constantemente en su juventud y de ese porcentaje sólo un 20% (n=6) lo sigue realizando, mostrando que el 50% (n=3) consume ½ paquete de cigarrillos al día y el restante 50% (n=3) un paquete.
Si analizamos los datos encontrados del alcoholismo y fumado, a pesar de realizar estas prácticas en el pasado, en la actualidad solo un porcentaje pequeño lo hace, lo cual es muy frecuente que ocurra en estas edades. Al contrastar la información encontrada por Caraguay (2015), que describe en su investigación que el alcoholismo estuvo presente en un 78% y tabaquismo en 53% y la que llevo a cabo Maza (2015) donde el consumo de alcohol obtuvo un 100% y el consumo de tabaco 71.4%, podemos evidenciar que los valores obtenidos son mucho más bajos y por tanto, no son similares con los reflejados en este estudio.
Por otra parte es clave entender que los pacientes que aún lo hacen son más propensos a desarrollar patología prostática, especialmente cáncer de próstata. López, expresa que “la asociación del alcoholismo y el cáncer de prostata, ha sido demostrada por muchas investigaciones, las cuales convergen en un incremento del 16% de padecer esta patología” (2016, p.37), lo cual está fundamentado en los efectos que produce sobre los estrógenos y testosteronas y el papel que juegan estos en el crecimiento prostático. Datos similares se obtienen del fumado con “un riesgo entre el 11 y el 22% mayor con respecto a los nunca fumadores, y de un 9% con los ex-fumadores” (Ferrís, et al, 2011, p. 290), esto considerando las bases biológicas que sugieren que las sustancias que se inhalan de los cigarrillos/tabaco son cancerígenas.
El 86.7% (n=26) de los pacientes poseían como patología crónica la Hipertensión, mientras que el restante 6.7% (n=2) tenían Diabetes Tipo II, patologías que no representan un riesgo significativo de padecer enfermedad prostática. A pesar de ser personas en su mayoría del campo (rural) sólo un 46.7% (n=14) realiza ejercicios de manera activa, mientras que el restante 53.3% (n=16) son sedentarios, práctica que juega un papel en contra a las enfermedades que poseen y que contribuyen a la presentación de complicaciones relacionadas.
En relación al consumo de carnes, el 80% (n=24) de los participantes refiere que prefieren consumir carnes con alto contenido graso, siendo el pollo la carne más consumida por estos. De manera particular de obtuvo que solo un 26.7% (n=8) consume únicamente pollo y el restante 73.3% (n=22) consume res, pollo, cerdo y embutidos. Es importante mencionar, que a pesar de que estos pacientes asisten periódicamente a controles de sus patologías, es contraproducente la actitud que toman antes el ejercicio y el consumo de carnes grasas, ya que afectará su calidad de vida a largo plazo.
Tabla 1. Índice de Masa Corporal (IMC)
| Frecuencia | Porcentaje | Porcentaje válido | Porcentaje acumulado | ||
|---|---|---|---|---|---|
| Válidos | < 30 | 19 | 63.3 | 63.3 | 63.3 |
| >30 | 11 | 36.7 | 36.7 | 100.0 | |
| Total | 30 | 100.0 | 100.0 | ||
Fuente: Aplicación del instrumento
El sedentarismo y el abuso de carnes grasas se traduce por lo general a sobre peso y se puede corroborar con los datos encontrados al calcular el IMC de cada paciente, donde se obtuvieron IMC desde 20 a 63, distribuyéndose en general el 63.3% (n=19) con IMC menor a 30 y un 36.7% (n=11) IMC mayor a 30. Si comparamos los datos reflejados por Arce & Tenesaca (2015), expresan que en su estudio el sedentarismo se mostró en un 20.7%, valor por debajo del reportado en esta investigación y el sobre peso (IMC >30) en un 23.1%, resultados no muy alejado que el encontrado anteriormente (36.7%). No se evidencian investigaciones de referencia con la cual puedan relacionarse los datos obtenidos para el consumo de carnes grasas.
Lo relevante aquí con respecto a la investigación es destacar que “las dietas con alto contenido de grasa, sobre todo en ácidos grasos polinsaturados, parecen las más relacionadas con el Cap [Cáncer de próstata], especialmente el consumo de carnes rojas” (Ruíz, 2018, p. 15) y “ un IMC mayor a 30 se asocia con mayor riesgo de cáncer de próstata localizado y metastásica, así como con mayor mortalidad (…), considerándose que por cada incremento de 5 unidades de IMC se aumenta un 5% de desarrollar cáncer de próstata” (Arce & Tenesaca, 2015, pp. 32-33).
Con respecto a la sexualidad de los pacientes, se encontró que el 86.7% (n=26) durante su juventud tenía vida sexual activa mayor a 3 veces a la semana, mientras que los demás 13.3% (n=4) tenía actividad sexual activa menos a 3 veces a la semana y que a pesar de la edad, el 73.3% (n=22) de las personas sigue teniendo una vida sexual activa, lo cual juega un papel a favor para reducir la probabilidad de afecciones prostáticas, esto basándose en literaturas que mencionan que el semen contiene sustancias que pueden dañar las células de las próstata si se mantienen acumuladas por mucho tiempo.
Gráfico 5. Exposición a Herbicidas y Pesticidas
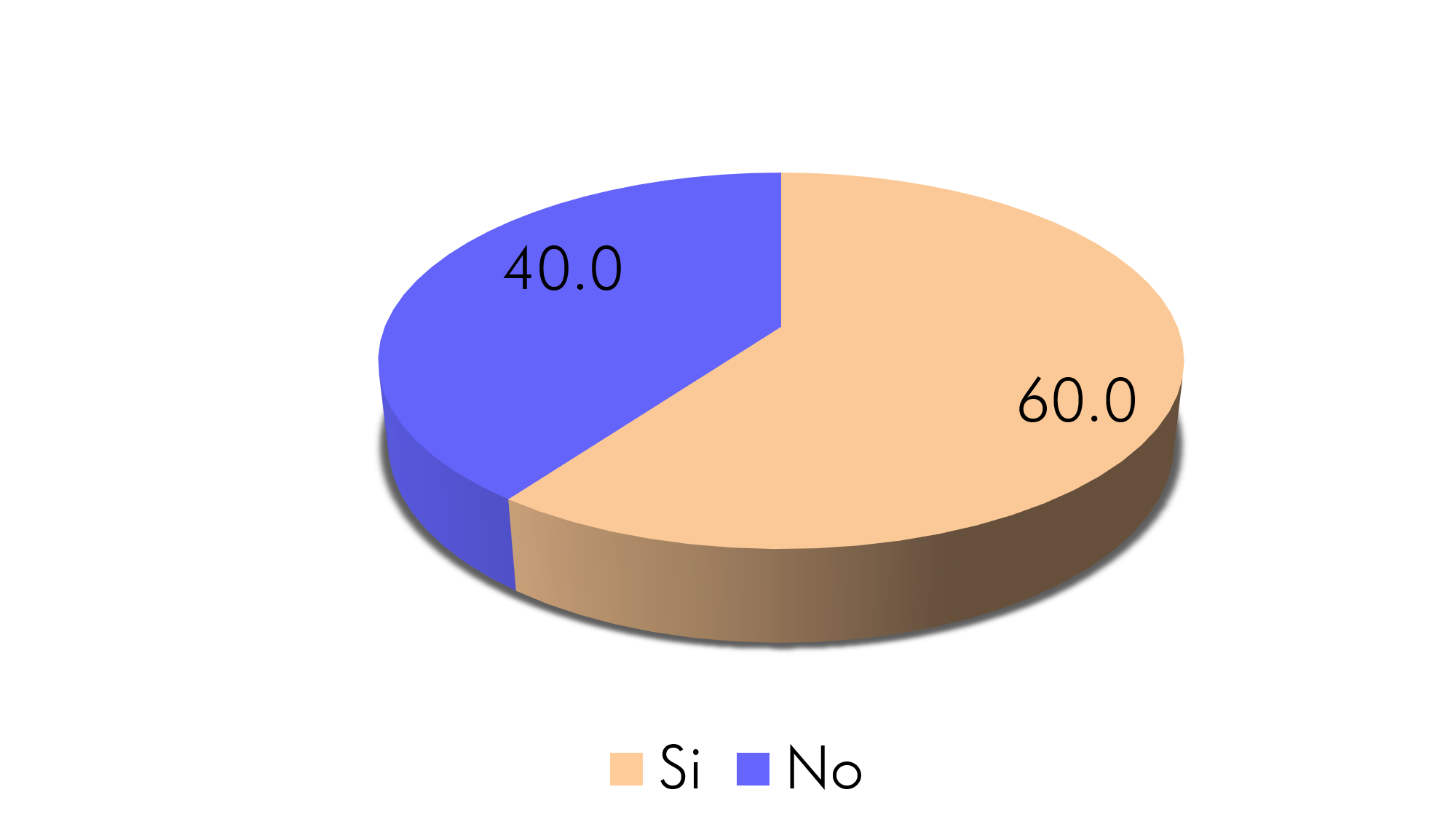
Fuente: Aplicación del instrumento
Un punto importante a evaluar fue la exposición de los pacientes a herbicidas y pesticidas, lo cual es un condicionante importante en la aparición de cáncer prostático. En nuestro medio recobraría mayor interés los agentes químicos órganos fosforados, ya que estos son los que se utilizan generalmente en las zonas rurales para tratar malezas y plagas en lo que respecta a la preparación y tratamiento del suelo para los cultivos. Los datos obtenidos fueron que el 60% (n=18) (Caraguay, 2015 reflejó la exposición a agroquímicos en un 88%) de los participantes ha tenido contacto con herbicidas y pesticidas durante su vida; y de estos el 100% fue mayor a 5 años de exposición; donde si valoramos lo expresado por Ferrís, et al, de que “las personas expuestas a herbicidas tienen mayor probabilidad de enfermedad metastásica y probabilidad aumentada de 7,8 y 12% respectivamente comparado con la población general” (2011), podemos enfatizar que es un punto clave de tomar en consideración.
Gráfico 6. Concentración de PSA obtenida del análisis del suero de los pacientes por método ELISA
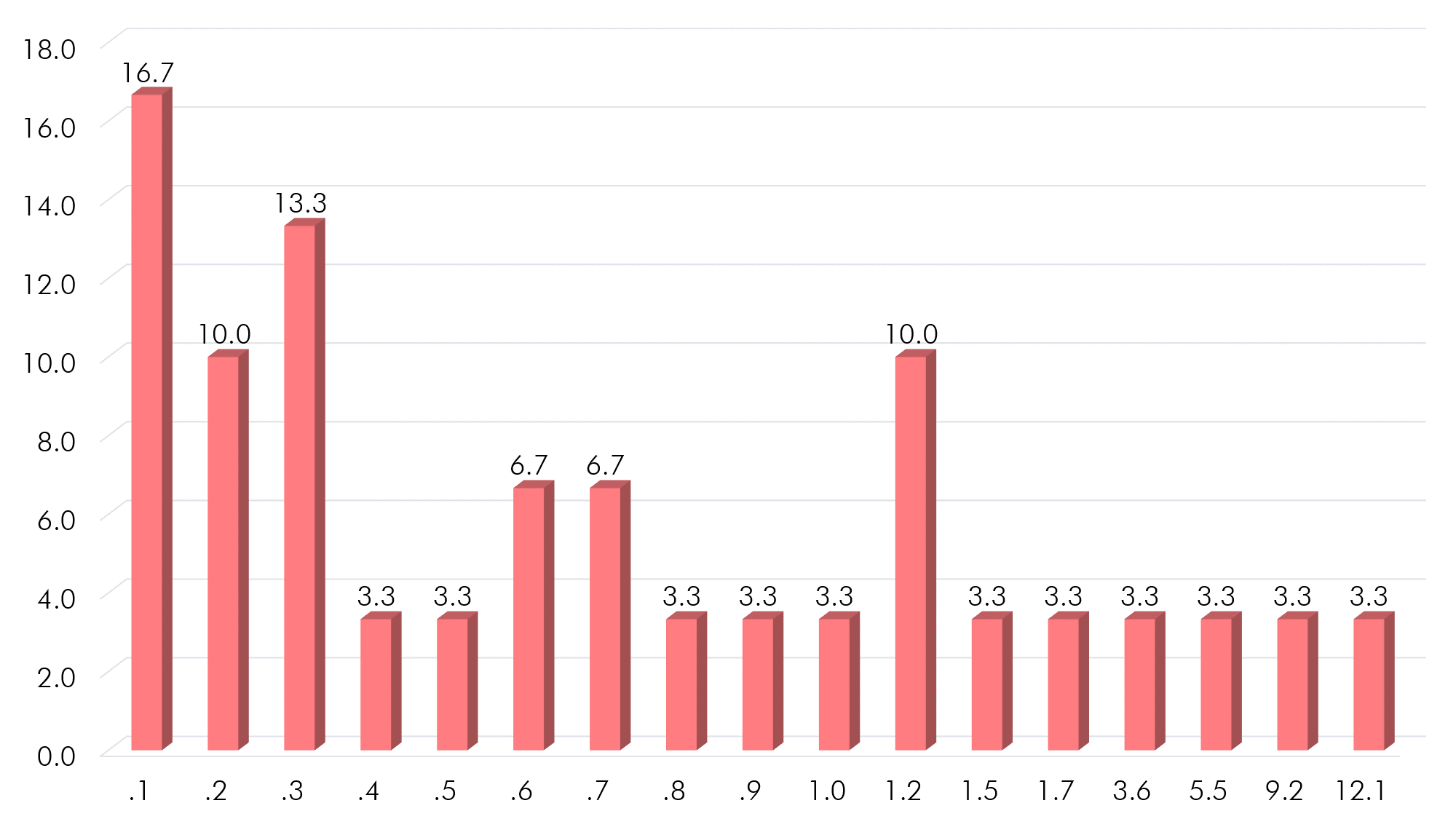
Fuente: Aplicación muestreo a muestras biológicas
La concentración media de PSA encontrada fue de 1.52 ng/ml ± 2.75. La concentración que más se repitió fue la de 0.1 ng/ml con un 16.7% (n=5). El valor mínimo de PSA fue 0.1 ng/ml y valor máximo de 12.1 ng/ml. Las concentraciones de manera decrecientes son 16.7% (n=5) para 0.1 ng/ml, 13.3% (n=4) para 0.3 ng/ml, 10% (n=3) para 0.2 y 1.2 ng/ml, 6.7% (n=2) para 0.6 y 0.7 ng/ml y 3.3% (n=1) para las demás determinantes.
Gráfico 7. PSA, según valores de referencia
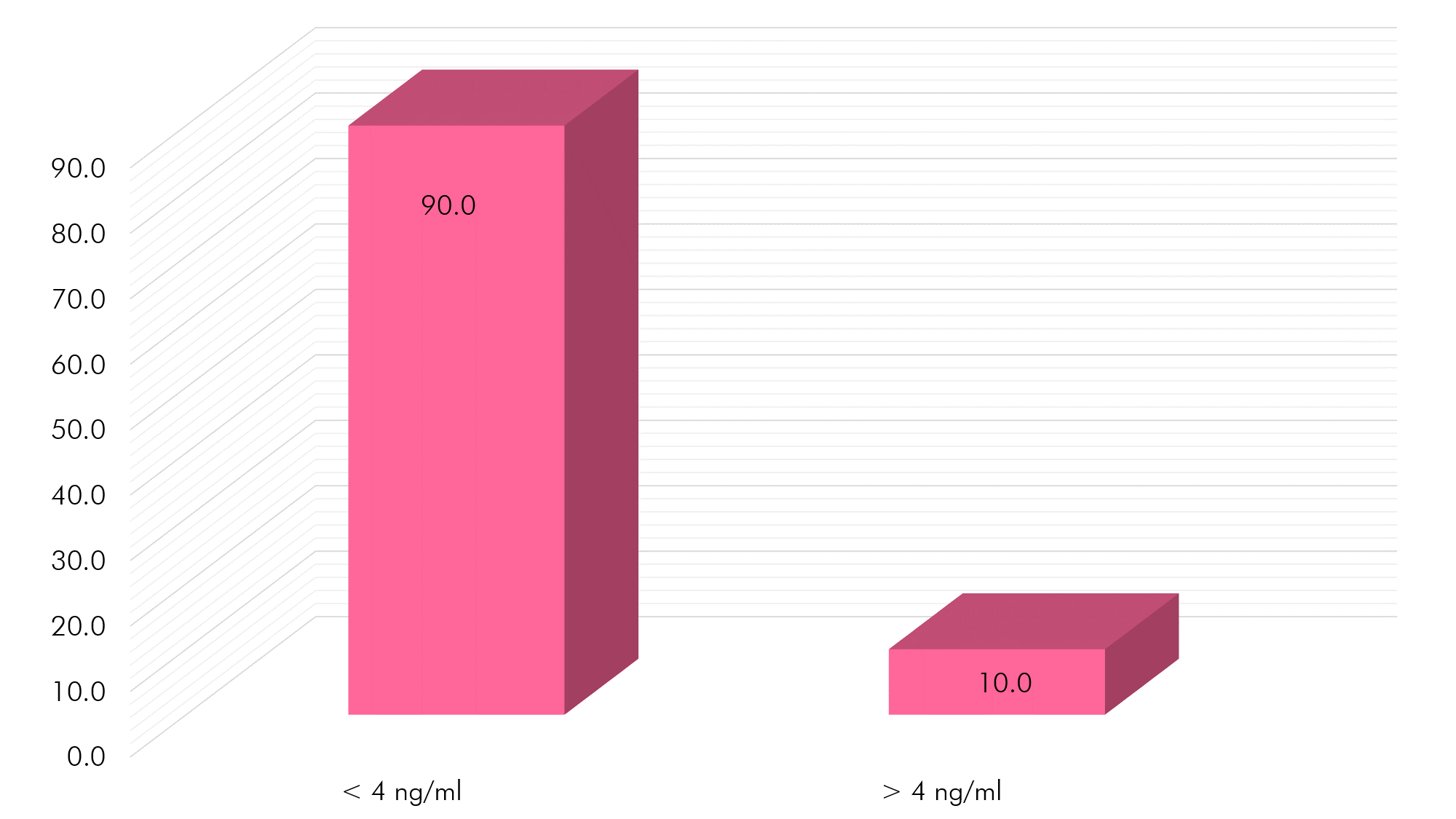
Fuente: Aplicación muestreo a muestras biológicas e inserto HUMAN
Si analizamos las concentraciones obtenidas de PSA según valores de referencia, podemos decir que el 90% (n=27) posee valores normales (<4ng/ml) y un 10% (n=3) valores aumentados (>4 ng/ml) de PSA, con lo cual, como se ha referido no podemos inferir directamente que estos pacientes con resultados por encima de lo normal poseen cáncer de próstata. Es oportuno mencionar que estos resultados son muy similares a los encontrados por Maza (2015) y Arce & Tenesaca (2015) con un 13% y 14% respectivamente y muy alejados a los reportados por las investigaciones realizadas en nuestro país, aunque es de esperar, debido a que al tipo de poblacion escogida para este estudio, se le desconoce su estado actual prostático (como en el caso de las investigaciones de Loja y Cuenca) mientras que en las realizadas por Fitoria (2012) y Trujillo (2015) se abordaron pacientes diagnosticados con anterioridad con enfermedades prostáticas.
Tabla 2. Edades según grupos etáreos * PSA, según valores de referencia
| PSA, según valores de referencia | Total | |||
|---|---|---|---|---|
| < 4 ng/ml | > 4 ng/ml | |||
| Grupo Etáreo | 50-55 | 9 | 0 | 9 |
| 56-60 | 3 | 0 | 3 | |
| 61-65 | 6 | 0 | 6 | |
| 66-70 | 4 | 0 | 4 | |
| 71-75 | 0 | 2 | 2 | |
| 76-79 | 5 | 1 | 6 | |
| Total | 27 | 3 | 30 | |
| X2: 20.74 gl: 5 p: 0.95 a: 0.05 VC: 11.070 | ||||
Fuente: Aplicación del instrumento y muestreo biológico
Los grupos etáreos comprendidos entre 50 a 70 años presentaron valores normales de PSA (<4ng/ml), mientras que los de 71 a 75 (n=2) mostraron valores aumentados; con respecto a los de 76-79 años (n=6), 5 de ellos obtuvieron valores normales y 1 valores aumentados. Se calculó un X2 de 20.74 y un Valor Crítico (VC) de 11.070, habiendo dependencia entre las dos variables; no obstante, si interpretamos los valores encontrados de PSA, estos no muestran correspondencia con lo mencionado por Caraguay (2015), sobre los valores de referencia de PSA por rango de edades.
Tabla 3. Antecedentes Familiares * PSA, según valores de referencia
| PSA, según valores de referencia | Total | |||
|---|---|---|---|---|
| < 4 ng/ml | > 4 ng/ml | |||
| Antecedentes Familiares | Si | 3 | 2 | 5 |
| No | 24 | 1 | 25 | |
| Total | 27 | 3 | 30 | |
| X2: 6.00 gl: 1 p: 0.95 a: 0.05 VC: 3.841 | ||||
Fuente: Aplicación del instrumento y muestreo biológico
De los pacientes que poseen antecedentes familiares (n=5), 3 de ellos tenían valores normales de PSA y 2 valores aumentados; mientras que, de los que no tenían antecedentes (n=25) solo 1 presentó valores aumentados de PSA, mostrando una distribución a favor de las personas que sí tenían antecedentes. Se obtuvo un X2 de 6.0 y VC 3.841, teniendo como resultado de que existe relación entre antecedentes familiares y concentración de PSA.
Tabla 4. Antecedentes familiares: Parentesco Familiar * PSA, según valores de referencia
| PSA, según valores de referencia | Total | |||
|---|---|---|---|---|
| < 4 ng/ml | > 4 ng/ml | |||
| Parentesco Familiar | Papá | 1 | 0 | 1 |
| Abuelo | 1 | 0 | 1 | |
| Hermano | 1 | 2 | 3 | |
| Total | 3 | 2 | 5 | |
| X2: 2.22 gl: 2 p: 0.95 a: 0.05 VC: 5.991 | ||||
Fuente: Aplicación del instrumento y muestreo biológico
De las personas con parentesco de hermano (n=3), 2 presentaron valores > 4 ng/ml de PSA; de los demás con parentesco de papá y abuelo mostraron valores < 4 ng/ml de PSA. Lo cual correlaciona con la literatura médica, que sugiere que las patologías prostáticas no siguen una transmisión mendeliana y que en este caso se logró corroborar, ya que no se encontró relación entre el parentesco familiar y los valores de PSA, con un X2 de 2.2 y VC de 5.991. Es relevante mencionar que los 2 casos con alteración corresponden a parientes de consanguinidad II, lo cual contrasta con los resultados obtenidos por Trujillo (2015), donde los más afectados fueron de consanguinidad I.
Tabla 5. Alcoholismo * PSA, según valores de referencia
| PSA, según valores de referencia | Total | |||
|---|---|---|---|---|
| < 4 ng/ml | > 4 ng/ml | |||
| Alcoholismo | Si | 10 | 0 | 10 |
| No | 17 | 3 | 20 | |
| Total | 27 | 3 | 30 | |
| X2: 1.67 gl: 1 p: 0.95 a: 0.05 VC: 3.841 | ||||
Fuente: Aplicación del instrumento y muestreo biológico
De los pacientes que se catalogaron como alcohólicos, el 100% mostró valores normales de PSA y de los que no toman este tipo de bebidas (n=20), 3 (el 100% de los casos con valores alterados de PSA) de ellos obtuvieron valores aumentados (X2: 1.67; VC: 3.841). Referente al fumado se encontró lo contrario, debido que las personas que eran fumadores activos (n=25), 3 de ellos obtuvieron concentración de PSA >4 ng/ml y de los que no fumaban mostraron valores < 4 ng/ml(X2: 0.67; VC: 3.841). Datos que en ambos casos no guardan relación con la literatura encontrada sobre alcoholismo y fumado y que en este caso no existe correlación entre estas dos determinantes y la concentración de PSA.
Tabla 6. IMC * PSA, según valores de referencia
| PSA, según valores de referencia | Total | |||
|---|---|---|---|---|
| < 4 ng/ml | > 4 ng/ml | |||
| IMC | < 30 | 17 | 2 | 19 |
| >30 | 10 | 1 | 11 | |
| Total | 27 | 3 | 30 | |
| X2: 0.016 gl: 1 p: 0.95 a: 0.05 VC: 3.841 | ||||
Fuente: Aplicación del instrumento y muestreo biológico
Con respecto al ejercicio, de los que obtuvieron valores >4 ng/ml, 1 si se ejercitaba y los otros 2 no (X 2: 0.238; VC: 3.841), de las personas que consumen carnes grasosas (n=24), los 3 valores con alteración de PSA se encontraban en este grupo (X 2: 0.833; VC: 3.841). Así mismo, se evidenció que de los que tenían IMC < 30, dos casos pertenecían a este grupo y el otro a los que poseían IMC > a 30 (X 2: 2.73; VC: 3.841). De igual manera no se encontró relación entre los pacientes con vida sexual activa (n=22) y los niveles de PSA, debido que sólo 1 mostro niveles aumentados de este, encontrándose los otros 2 valores aumentados en los no sexualmente activo (X 2: 2.73, VC: 3.841).
Tabla 7. Exposición a herbicidas y pesticidas * PSA, según valores de referencia
| PSA, según valores de referencia | Total | |||
|---|---|---|---|---|
| < 4 ng/ml | > 4 ng/ml | |||
| Exposición a herbicidas y pesticidas | Si | 16 | 2 | 18 |
| No | 11 | 1 | 12 | |
| Total | 27 | 3 | 30 | |
| X2: 0.062 gl: 1 p: 0.95 a: 0.05 VC: 3.841 | ||||
Fuente: Aplicación del instrumento y muestreo a muestras biológicas
De los pacientes que habían tenido contacto con herbicidas y pesticidas (n=18), sólo 2 mostraron valores aumentados de PSA y de los que no ,1 obtuvo valores > 4 ng/ml, determinándose que no existe dependencia entre el contacto con herbicidas y pesticidas con los valores de PSA (X2: 0.062, VC: 3.841); esto a pesar de que la información encontrada y descrita por otros autores sugiere una relación intrínseca entre el contacto por estas sustancias y la aparición de patologías prostáticas, lo cual condiciona la alteración del PSA.
CONCLUSIONES
Los pacientes abordados poseían características médicas idóneas para el estudio, teniendo principalmente a los factores endógenos como las edades que oscilaban entre los 50 a 79 años y un bajo porcentaje de participantes (16.7%) que presentaban antecedentes familiares asociados a cáncer de próstata. Con respecto a los factores exógenos estudiados, el alcoholismo se presentó en un 33.33%, el fumado 20%, el sedentarismo 53.3%, el consumo de carnes grasosas 80%, IMC >30 36.7%, contacto con herbicidas y pesticidas 60% y sexualidad reducida 26.7%.
Al aplicar el método ELISA a las muestras obtenidas por punción venosa, se obtuvo concentraciones de PSA entre 0.1 a 12.1 ng/ml, mostrando un promedio de 1.523 ± 2.75 ng/ml. Los valores más recurrentes de PSA fueron los de 0.1 ng/ml en un 6.7% (n=5), seguido de 0.3 con 13.3% (n=4), 0.2 y 1.2 ng/ml 10% (n=3), 0.6 y 0.7 con 6.7% (n=2) y las demás determinantes con 3.3% (n=1). Según valores de referencia reportados por la casa comercial HUMAN con la que se trabajó, se determinó que el 90% de los pacientes presentó valor normal (< 4 ng/ml) de PSA y el 10% concentración aumentada (>4 ng/ml) de PSA.
Al analizar cada X2 cuadrada calculada, podemos inferir que no hubo dependencia entre la concentración de PSA y la totalidad de factores exógenos estudiados, encontrándose valores de chi cuadrado por debajo del valor crítico en todos los casos. Solo se encontró dependencia entre la edad (grupos etáreos) y la concentración de PSA con un X2 de 20.74 y VC de 11.070 y antecedentes familiares y PSA con un X2 de 6.0 y VC de 3.841; este último al compararlo con los valores de PSA según el parentesco familiar, sea de consanguinidad I o consanguinidad II, las variables se independizan (X2: 2.22 y VC: 5.991). Por tanto, se concluye que solo hay relación entre la concentración de PSA y el 18.18% de los factores de riesgo estudiados. Cabe mencionar que no se calculó el chi cuadrado para las variables etnia y valores de PSA, puesto que se presentó en un 100%, por tanto, no se puede establecer relación ya que no hay variabilidad de datos.
Es importante mencionar que por las características descritas que poseía esta población, se esperaba que la información obtenida como producto del estudio, fuese similar a la encontrada en la literatura médica. No obstante, si analizamos a detalle los datos obtenidos por las investigaciones internacionales citadas, podremos evidenciar que en la mayoría de los casos no se calculó el chi cuadrado y la relación se hizo a grosso modo; además, de que los factores exógenos asociados se presentaron en algunos casos mayores a los encontrados y aun así la alteración fue similar a la evidenciada en esta investigación.
REFERENCIAS
Arce, M., & Tenesaca, M. (2015). Determinación de PSA y factores de riesgo relacionados con alteraciones prostáticas en pacientes de 60 a 90 años (Tésis de grado). Cuenca, Ecuador: Universidad de Cuenca. Obtenido de http://dspace.ucuenca.edu.ec/bitstream/123456789/21607/1/TESIS.%20PDF.pdf
Arguedas, J. (2009). Antígeno Prostático Específico. Actualización Médica Periódica(93), 1-6. Obtenido de https://www.ampmd.com/documento.cfm?d=100036
Caraguay, E. (2015). Determinación de niveles de antígeno prostático específico y su relación con los factores de riesgo asociados a alteraciones prostáticas en varones mayores de 40 años de la asociación de agricultores del Cantón Pindal (Tesis). Loja, Ecuador: Universidad de Loja. Obtenido de https://dspace.unl.edu.ec/jspui/bitstream/123456789/13652/1/TESIS%20PSA.pdf
Ferrís, J., Berbel, O., García , J., López, J., Sobrino, E., & Ortega, J. (2011). Factores de riesgo ambientales no dietéticos en el cáncer de próstata. Actas Urológicas Españolas, 35(5), 289-295. Obtenido de https://scielo.isciii.es/pdf/aue/v35n5/revision2.pdf
Fitoria, A. (2012). Correlación entre los niveles séricos del Antígeno prostático específico y los diagnósticos histopatológicos en los pacientes con patologías prostáticas atendidos en el Hospital Escuela Oscar Danilo Rosales, León-Nicaragua, 2010-2011 (Tesis). León, Niacaragua: UNAN, León. Obtenido de http://riul.unanleon.edu.ni:8080/jspui/bitstream/123456789/4375/1/225293.pdf
Gómez, E., & Serrano, B. (2016). Urología básica para estudiantes de medicina (1 ed.). Loja, Ecuador: Universidad Nacional de Loja. Obtenido de https://issuu.com/universidadnacionaldeloja/docs/libro_de_urologi__a._dr._ortega_b._
Hernández, R., Fernández, C., & Pilar, B. (2014). Metodología de la Investigación (6 ed.). México: Mc Graw Hill.
López, L. (2016). Efecto de la exposición a factores de riesgo medioambientales en el cáncer de próstata (Tesis doctoral). Santander: Universidad de Cantabria. Obtenido de https://repositorio.unican.es/xmlui/bitstream/handle/10902/10834/Tesis%20LMLL.pdf?sequence=1
Maza, Y. (2015). PSA total y su relación con factores de riesgo que predisponen al desarrollo de alteraciones prostáticas en policias en servicio pasivo de la ciudad de Loja durante el período Marzo-Julio 2014 (Tesis monográfica). Loja, Ecuador: Universidad Nacional de Loja. Obtenido de https://dspace.unl.edu.ec/jspui/bitstream/123456789/13715/1/TESIS%20YESSENIA%20MAZA.pdf
Organización Mundial de la Salud (OMS). (2014). Perfiles oncológicos de los países, 2014. Nicaragua: OMS. Obtenido de https://www.who.int/cancer/country-profiles/nic_es.pdf
Ruíz, J. (2018). Factores de riesgo ocupacionales en personas de cáncer de próstata en el estudio Multicaso-control-Spain (MCC-Spain) (Tesis doctoral). Barcelona: Universidad Autónoma de Barcelona. Obtenido de https://www.tdx.cat/bitstream/handle/10803/650850/jmrd1de1.pdf?sequence=1&isAllowed=y
SILAIS Boaco. (2018). Tipos de tumores malignos en la población en general. Recuperado el 31 de enero de 2019, de SILAIS Boaco: http://mapasalud.minsa.gob.ni/mapa-de-padecimientos-de-salud-silais-boaco/
Trujillo, M. (2015). Correlación diagnóstica entre el antígeno prostático específico (PSA) y biopsia prostática para la detección temprana del cáncer de próstata en pacientes de Urología del Hospital Antonio Lenin Fonseca, Managua, 2013 (Tesis). Managua, Nicaragua: UNAN-Managua. Obtenido de https://repositorio.unan.edu.ni/6532/1/27366.pdf
© 2022 Revista Científica de FAREM-Estelí.
![]() Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
