Estimación de Biodegradabilidad del Efluente de las aguas residuales del CIRA/UNAN-Managua según ISO 10707 y OECD 301D
Estimation of Biodegradability of CIRA/UNAN-Managua Wastewater Effluent according to ISO 10707 and OECD 301D
Freddy Alexander Martínez Espinoza
Licenciado en Química Industrial. Universidad Nacional Autónoma de Nicaragua – Managua / Centro para la Investigación en Recursos Acuáticos de Nicaragua (CIRA/UNAN-Managua). Laboratorio de Radioquímica Ambiental.
https://orcid.org/0000-0002-6297-5298
m.espinozafreddy27@gmail.com
Felipe Cándido Mendoza Arriaza
Ingeniero Químico. Universidad Nacional Autónoma de Nicaragua – Managua / Centro para la Investigación en Recursos Acuáticos de Nicaragua (CIRA/UNAN-Managua). Laboratorio de Aguas Residuales.
https://orcid.org/0000-0001-5637-4130
felipe.mendoza@unan.edu.ni
RECIBIDO
10/12/2020
ACEPTADO
26/02/2021
RESUMEN
El estudio para estimar la biodegradabilidad de las aguas residuales del CIRA/UNAN-Managua, se realizó mediante la implementación del método ISO 10707 y Línea Guía de la OECD 301D, ensayos conocidos como biodegradabilidad última fácil o prueba de la botella cerrada; para ello fue necesario el desarrollo de un inóculo líquido, a partir de una alícuota proveniente del efluente de los sedimentadores secundarios de un sistema de tratamiento de origen biológico en un reactor aireado de mezcla completa; estos microorganismos permitieron biodegradar la materia orgánica del residual. La investigación contó con una inspección in situ para el reconocimiento del punto idóneo donde fueron tomadas las muestras, así como la medición del caudal; a su vez, se llevó acabo la caracterización físico-química del efluente, comparando los resultados con lo establecido en el Reglamento: Disposiciones para el Vertido de Aguas Residuales No. 21-2017 que especifica su artículo 22. La estimación del porcentaje de biodegradabilidad fue del 94,78%, obteniendo a partir de este resultado que el efluente es fácilmente biodegradable; paralelo a esto el análisis de los parámetros según los rangos máximos permisibles a caracterizar proporcionaron valores aceptables del agua residual con respecto al Reglamento.
PALABRAS CLAVES
Biodegradabilidad; inóculo; reactor; tratamiento biológico; caracterización.
ABSTRACT
The study to estimate the biodegradability of CIRA/UNAN-Managua wastewater was conducted through the implementation of the ISO 10707 method and OECD 301D Guide Line, tests known as last easy biodegradability or closed bottle test; this required the development of a liquid inoculum, from an aliquot from the effluent of secondary sedimentators of a biologically sourced treatment system in a full-mix aerated reactor; these microorganisms will allow the organic matter of the residual to be biodegraded. The investigation has an on-site inspection for the recognition of the appropriate point where the samples will be taken, as well as the measurement of the flow; in turn, the physical-chemical characterization of the effluent was carried out, comparing the results with the provisions of the Regulation: Provisions for the Discharge of Wastewater No. 21-2017 specified in Article 22. The estimate of the biodegradability percentage was 94.78%, a result that the effluent is easily biodegradable; parallel to this the analysis of the parameters according to the maximum permissible ranges to be characterized provided acceptable residual water values with respect to the Regulation.
KEYWORDS
Biodegradability; inoculum; reactor; biological treatment; characterization.
INTRODUCCIÓN
Para el desarrollo del principal objetivo en la investigación, fue preciso realizar la estimación del porcentaje de biodegradabilidad del efluente de las aguas residuales generadas en el Centro para la Investigación de Recursos Acuáticos CIRA/UNAN-Managua, mediante la inoculación de microrganismos que permitan degradar la materia contenida en el efluente en estudio; a su vez determinar las características físico-químicas del residual comparando los resultados con lo que establece el Reglamento No. 21-2017.
Cabe mencionar que el CIRA/UNAN-Managua, no cuenta con un sistema de tratamiento dirigido a sus aguas residuales, ya que en el anterior Decreto Ejecutivo No. 33 - 95 no establecía dentro de sus parámetros la inclusión de los centros de investigación y aquellas instalaciones que vierten sus aguas residuales al alcantarillado sanitario, por ello el centro se ha propuesto conocer la carga contaminante residual, con miras a cumplir con las demandas que se establecen en el nuevo Reglamento.
En este sentido la perspectiva de la investigación se centra en el montaje del ensayo de biodegradabilidad del efluente también conocida como biodegradabilidad última fácil o prueba de la botella cerrada, mediante los métodos de la ISO 10707 y línea guía de la OEDC 301D; paralelo a esto se desea conocer las características físico-químicas del efluente conforme a lo establecido en el Reglamento Disposiciones para el Vertido de Aguas Residuales No. 21-2017 en su artículo 22, permitiendo contemplar si el Centro cumple con los parámetros que delimita dicho reglamento.
Para ello la OECD (Organización para la Cooperación y el Desarrollo Económico) establece que la biodegradabilidad es un aspecto muy importante para la evaluación de las sustancias y para la descripción de su descomposición y mineralización a cargo de los microorganismos en el medioambiente. La prueba 301D (prueba de la botella cerrada) puede determinar una gran variedad de compuestos, debido a que se basan en el seguimiento de parámetros que analizan el Carbono Orgánico Disuelto (COD), o bien de parámetros indirectos correlacionados con la mineralización de la molécula, como la Demanda Bioquímica de Oxígeno (DBO) o la producción de CO2. Este método es aplicable para determinar la biodegradabilidad fácil de los productos químicos orgánicos.
Mientras que la ISO 10707 indica que este método puede implementarse en aquellos compuestos orgánicos que son suficientemente solubles en agua; para la determinación de la biodegradabilidad es necesario la aplicación del análisis de la Demanda Bioquímica de Oxígeno (DBO), evaluando de esta manera la biodegradabilidad de los compuestos orgánicos en una concentración dada gracias a la utilización de microorganismos aerobios.
Según Vázquez y Beltrán, (2004) la biodegradabilidad ha sido definida como la capacidad intrínseca de una sustancia a ser transformada en una estructura química más simple por vía microbiana. A partir de esta afirmación se obtiene que tanto la biodegradabilidad y las aguas residuales, son dos conceptos estrechamente vinculados, teniendo en cuenta que gran parte de las sustancias que transporta el agua, es materia orgánica, la cual en gran medida es biodegradable. Mientras que Peña (2013) hace énfasis que la biodegradabilidad de estas sustancias es la propiedad que permite que las aguas residuales puedan ser depuradas por medio de microorganismos, los que utilizan esta matriz como alimento y fuente de energía para su metabolismo y reproducción.
A su vez, Ottenbrite y Albertsson, (1992) mencionan que el estudio de la biodegradabilidad permite conocer la capacidad en la cual una sustancia puede ser transformada a una estructura más simple por medio de una vía microbiana. Dado a esto es imperativo mencionar el papel desempeñado por el inóculo en la investigación, ya que el desarrollo, reproducción e inducción de este consorcio de microorganismos permiten la realización del ensayo de biodegradabilidad.
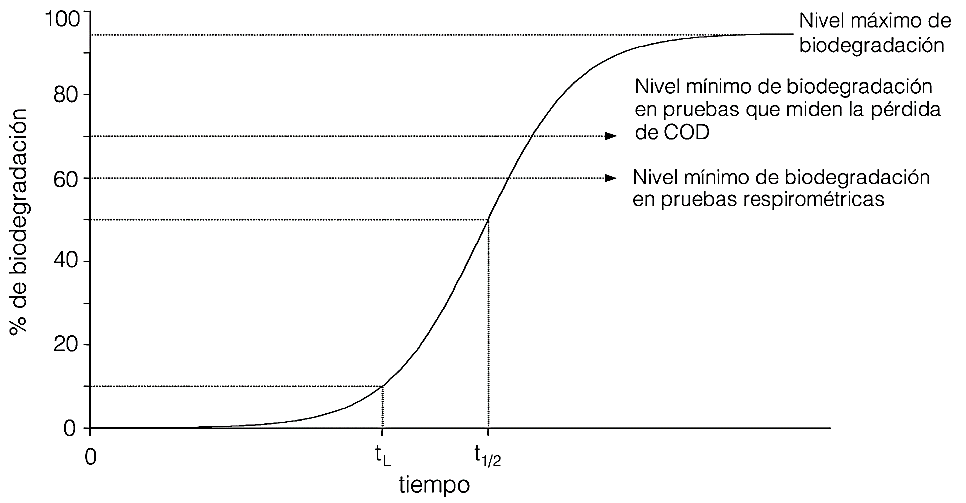
Figura 1. Representación esquemática de un proceso de biodegradación. Fuente: Vázquez y Beltrán, (2004)
La representación de la tendencia que debe seguir el ensayo de biodegradabilidad debe ir en aumento durante los 28 días que tarda el ensayo, transcurrido la mitad del tiempo o más bien descrito en el día 14, se estima que este proceso debe cumplir con el 60% de biodegradación de la matriz, siendo el nivel mínimo de biodegradación en este tipo de pruebas tal como se muestra en la figura 1. De no cumplir con el porcentaje establecido (menor al 60% en el día 28) es denominada como biodegradabilidad inherente; para lo cual Kaiser, (1998) establece que, si el resultado de la prueba de simulación pertinente es negativo, se presume que la sustancia persiste en el ambiente y que puede considerársele sujeta a restricciones.
Debido a lo antes descrito, el CIRA/UNAN-Managua ha manifestado su interés por el estudio de la biodegradabilidad convirtiéndolo en prioridad, dado que dicho parámetro es determinante en el comportamiento ambiental de las sustancias químicas generadas en los diferentes procesos industriales; de forma general los efluentes se encuentran ampliamente cargados de agentes contaminantes tales como: detergentes, pesticidas, metales pesados entre otros, lo que produce consecuencias negativas para los cuerpos de aguas receptores.
MATERIALES Y MÉTODOS
La presente investigación posee un enfoque de la metodología mixta, ya que presenta características tanto cualitativas como cuantitativas, debido que se determinaran parámetros de diversos análisis para caracterizaciones físico-químicas, estimación de la biodegradabilidad y desarrollo de microorganismos mediante la inoculación de bacterias de origen aeróbico; para la recopilación y medición de los datos e implementación de la metodología, fue necesaria la utilización de herramientas estadísticas que permitan la resolución de los resultados; esto mediante la comprobación de la hipótesis con base a mediciones numéricas, con el fin de establecer pautas de comportamiento que faciliten la validez, confiabilidad y factibilidad de los resultados (Hernández Sampieri, 2014)
A partir de lo antes mencionado se establece que la investigación posee un alcance experimental, puesto que se utilizaron técnicas y métodos para la evaluación de la efectividad del análisis de cada una de las variables en estudio; este alcance se presenta mediante la manipulación de una o más variables no comprobadas (estimación de biodegradabilidad), esto en condiciones controladas con el fin de describir de qué modo o porque causa se produce una situación o acontecimiento particular. (Tamayo Tamayo, 2002)
Según Custodio Ruiz (2008), el método lógico deductivo consiste en encontrar principios desconocidos a partir de consecuencias conocidas; tal es el caso del efluente en estudio; en este se determinará la biodegradabilidad y características físico-químicas por medio de métodos de alta precisión, considerando detalladamente como se espera que se comporten estos parámetros; por lo tanto, aunque en cierto modo se puede predecir sin estudios previos el comportamiento del porcentaje de biodegradabilidad por las cargas de contaminantes residuales vertidas al alcantarillado, lo cual justifica y vuelve necesaria la obtención de datos reales, logrando así conocer plenamente que tan degradable es la materia contenida en el residual.
Para estudiar la estimación de biodegradabilidad es necesario conocer la procedencia del efluente, por lo cual, la población que engloba la investigación se encuentra dada por la caja de registro que se conecta directamente con la red alcantarillado sanitario de la alcaldía de Managua, en dicha caja son depositados los residuos líquidos o aguas residuales generadas por los distintos laboratorios de ensayo, oficinas, baños, área administrativa y comedor.
Mientras que la toma de decisión para establecer la muestra es por conveniencia para la investigación, ya que permite la adecuación de la recolección de la información para el estudio y se encuentra primeramente conformado por una inspección in situ para el reconocimiento del efluente final donde será tomada la alícuota para los posteriores análisis correspondientes que dicta el reglamento No.21-2017 y la metodología para el ensayo de biodegradabilidad; el muestreo en el efluente tendrá una duración de 8,5 horas (muestreo compuesto).
Respecto a las técnicas para la recogida de los datos de información se implementó la comparación de los resultados mediante el estudio cualitativo y cuantitativo; para ello Pocovi (2003) expresa que uno de los principios básicos de la investigación es obtener los datos y la información directamente de la persona o del sujeto/objeto de investigación. Por lo tanto, hay diferentes maneras de obtener esa información dependiendo del tipo de investigación y de los objetivos de la misma.
A partir de lo antes mencionado se destaca que la variante presentada por la investigación se encuentra en el contenido de esa información y la manera de cómo se utiliza, para ello se enmarca la comparación de los resultados conforme a su caracterización físico–química del efluente según lo establecido en el Reglamento No. 21-2017, mientras tanto la estimación de la biodegradabilidad como el desarrollo del inóculo con lo dictado de la norma ISO 10707 y línea guía de la OECD 301D.
En lo que respecta a las etapas de la investigación, esta se adecua en la identificación de aquellos elementos claves en el estudio para la estimación de biodegradabilidad; de este modo la investigación se centra en el desarrollo de la experimentación científica con pruebas de ensayo y error: por el compendio basado en el Reglamento No. 21-2017, en la norma de la ISO 10707 y línea guía de la OECD 301D; por lo tanto, la investigación depende de las características del efluente, las variables en estudio y de su problemática; teniendo en cuenta tanto su naturaleza como las circunstancias a las cuales es sometida.
De esta manera Custodio (2008) explica que la experimentación científica consiste en el aislamiento del fenómeno para sus análisis posteriores y mejor comprensión. A su vez destaca que el objetivo del experimento puede esclarecer determinadas leyes, relaciones o detectar en el objeto una determinada propiedad; verificando una hipótesis, una teoría, un modelo. Expresando a su vez que un mismo experimento puede llevarse a cabo con variados fines.
RESULTADOS Y DISCUSIÓN
Los fundamentos empleados en el análisis y discusión de los resultados que presenta el estudio, serán abordados a partir de los objetivos de la investigación, así como las diversas variables.
Inspección in situ, medición del caudal y toma de la muestra
- Inspección in situ
El día miércoles 28 de noviembre del año 2018 se realizó la inspección in situ y reconocimiento del punto idóneo donde serán recolectadas las muestras, en este lugar se conectan todos los efluentes, disposición final hacia la red alcantarillado. El lugar del muestreo es identificado como Efluente Final como se muestra en la figura 2; para la ubicación más cercana a la locación de muestreo, se realizó la medición de las coordenadas y elevación:
- Coordenadas N: 1339680
- Coordenadas E: 579747
- Elevación: 132 msnm
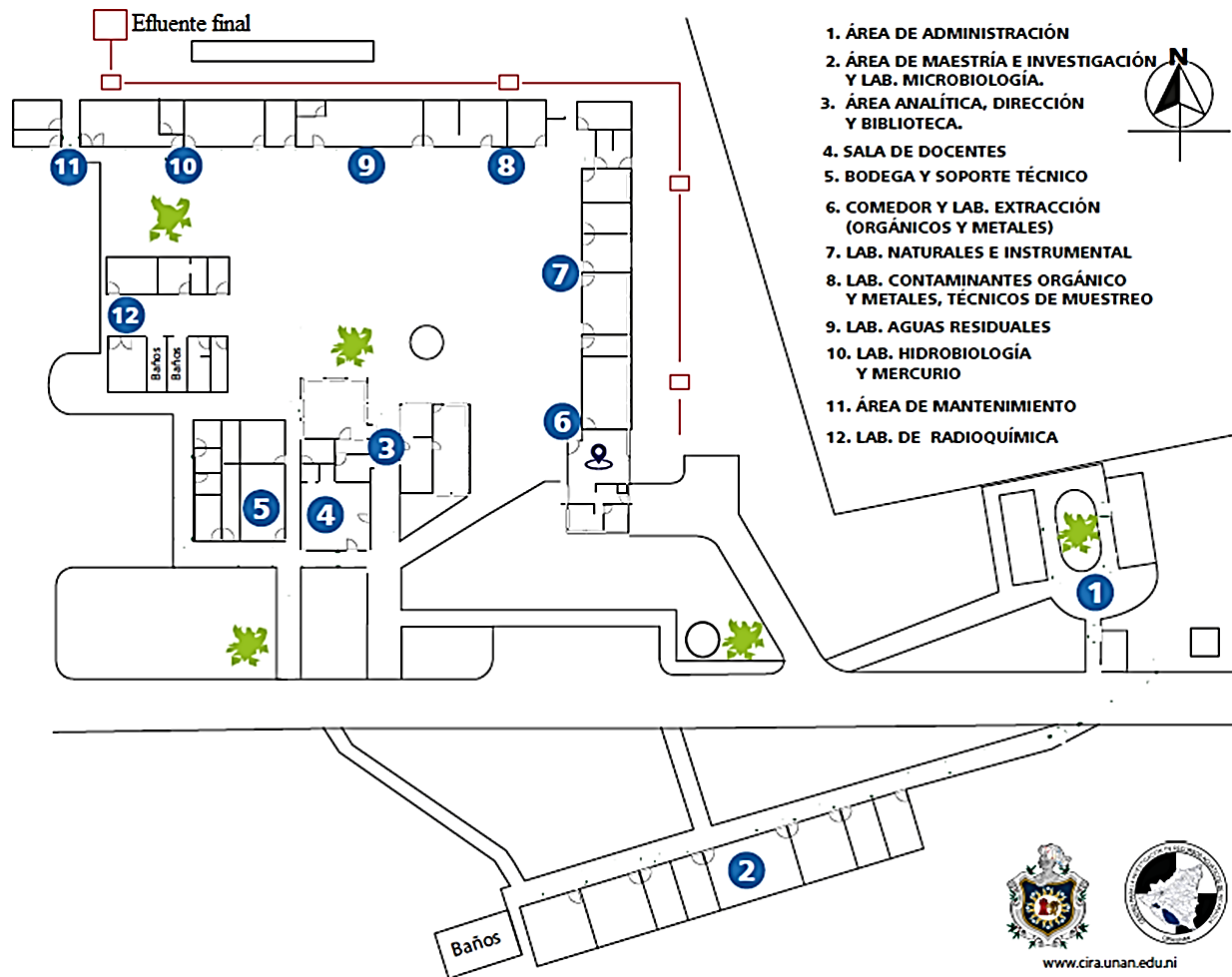
Figura 2. Recorrido del efluente; fuente: CIRA/UNAN-Managua, modificado por el autor.
Estas coordenadas son reportadas con el fin de obtener datos históricos, las cuales sirvan como referencia para una fácil ubicación del lugar de muestreo, para investigaciones futuras.
- Medición del caudal
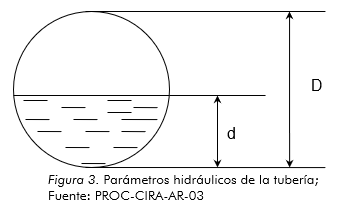
Para la medición del caudal fue necesario observar las características del punto de muestreo o el lugar en el cual será medido este; dado a las condiciones del sitio en cuestión se decidió utilizar la ecuación empírica de Manning, la cual permitió conocer la alícuota sustraída del efluente. Se realizaron 5 mediciones o aforo del caudal, de los cuales en tres de ellos también se tomaron muestras para análisis de laboratorio o caracterización del efluente. La fórmula descrita se presenta en la figura 3.
Para el cálculo del caudal por el método de Manning es necesario tener en cuenta las siguientes ecuaciones:

Expresando la ecuación del cálculo del caudal de la siguiente manera:
Donde:
Q = Caudal (m3/s)
v = Velocidad (m/s)
n = Coeficiente de rugosidad
Rh = Radio hidráulico (m)
s = Pendiente
A = Área mojada (m2)
Θ = Angulo (Grados)
D = Diámetro de la tubería (m)
d = Tirante (m)
Las 5 mediciones del caudal iniciaron a las 08h00, teniendo un intervalo de tiempo entre cada medida de 30 min, y finalizando a las 16h30, se obtuvieron datos relevantes en las variaciones del caudal, siendo 2,90 L/s el valor máximo reportado en las 5 mediciones del caudal; también se logra apreciar datos muy constantes y frecuentes en el efluente, considerando que el valor reportado de 0,70 L/s de caudal es constante, tal como se aprecia en la figura 4.
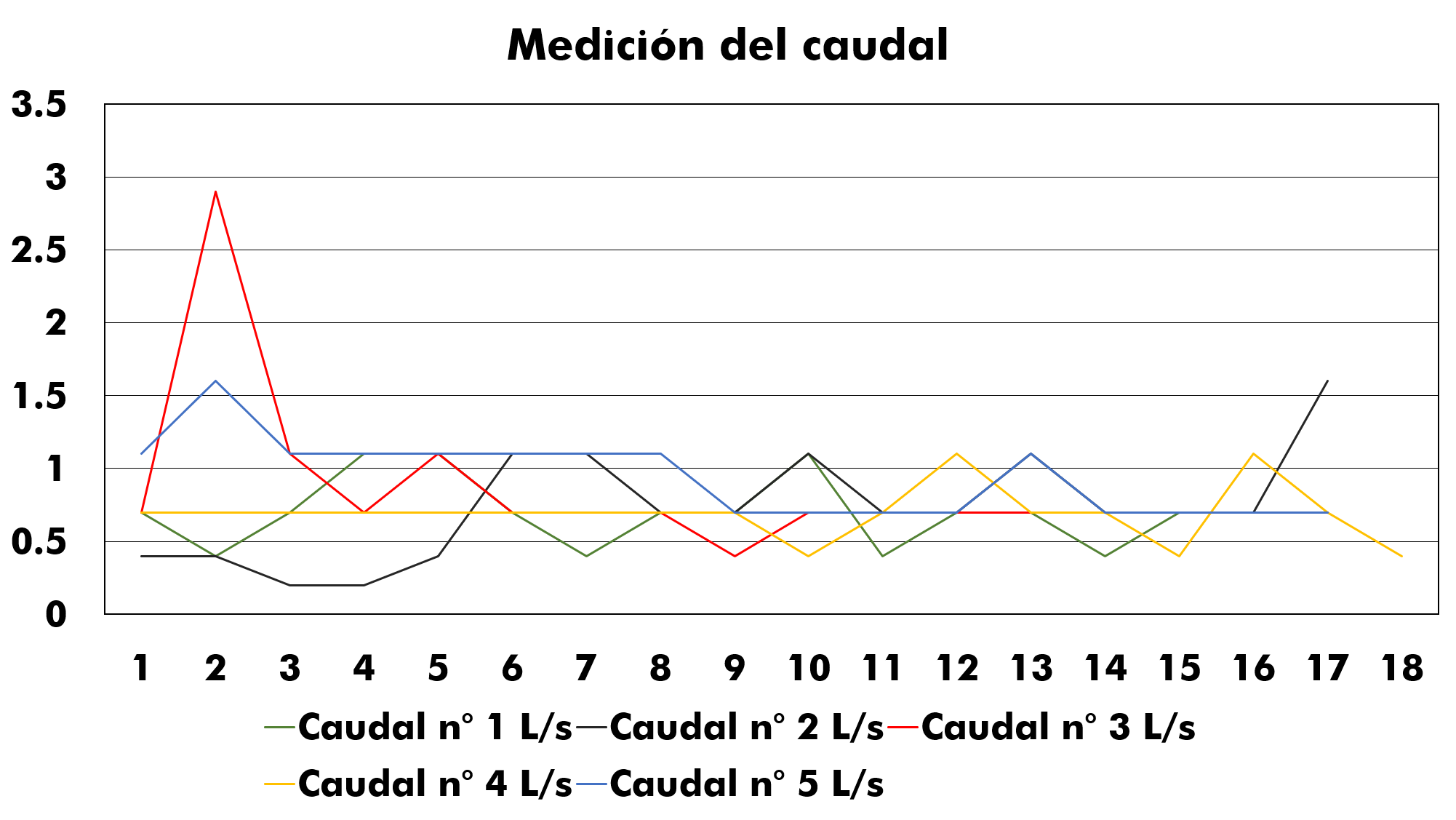
Figura 4. Medición del caudal del efluente final.
Cabe mencionar que la variabilidad que presentan los valores del caudal, se debe probablemente a la producción que se realizaba en estas fechas en los laboratorios; tomando en cuenta que en los meses en los que se realizaron los aforos, son fechas en las cuales el ingreso de las muestras disminuye considerablemente, ya que son fechas de cierre de año y apertura de uno nuevo.
- Toma de la muestra
El día 18 de diciembre del año 2018, se realizó el primer muestreo compuesto con duración de 7,5 horas. La cantidad de muestra a conocer o el volumen recolectado del efluente final del Centro, se encuentra sumamente ligado a los parámetros descritos en el Reglamento de las Disposiciones de los Vertidos de las Aguas Residuales cita, permitiendo así disponer del material necesario o envases en los que la muestra será traslada al laboratorio para sus análisis.
La ecuación a utilizar para conocer la alícuota que deber ser tomada del efluente que conforma la muestra compuesta se muestra en la ecuación 6:
Donde:
Vnecesario: Volumen a recolectar (ml)
Vtotal: Volumen total (ml)
Qpromedio: Caudal Promedio
Qhorario: Caudal horario (L/s)
N°muestra: Numero de muestras
Los muestreos compuestos contaron con una duración aproximada de 8,5 horas, donde se consideró recolectar 12 000 ml de muestra total, teniendo en cuenta los parámetros físico-químicos que serán determinados en la caracterización del efluente. Cabe mencionar que paralelo a la toma de la muestra y medición del caudal se realizó la obtención de parámetros de campo como pH, conductividad eléctrica y temperatura.
Los muestreos compuestos permiten obtener una muestra representativa del caudal en función de las descargas en el efluente, las mediciones de los parámetros en cuestión permiten conocer las condiciones en las cuales se encuentra el residual y las posibles interferencias que pueden presentarse.
Caracterización físico-química del efluente
Para la caracterización físico-química de las muestras de las aguas residuales recolectadas en el efluente final del CIRA/UNAN-Managua, se debe tomar en cuenta las disposiciones para el vertido de las aguas residuales /utilizar mayúsculas igual que la anterior contempladas en el Reglamento No. 21-2017 en el artículo 22. Para ello, dichas muestras fueron trasladadas a los laboratorios encargados en la determinación de los parámetros implementados en el Reglamento.
Los análisis llevados a cabo se encuentran separados en 3 grupos: Agentes Físicos (Sólidos suspendidos, calor), Agentes Químicos (pH, Sustancias consumidoras de oxígeno disuelto, Nutrientes, Aceites y grasas) y Compuestos Metálicos; para lo cual, tanto los agentes físicos como químicos son trasladados para su análisis en el Laboratorio de Aguas Residuales, y los compuestos metálicos serán analizados en el Laboratorio de Contaminante Metálicos, ambas instalaciones forman parte del Centro donde es realizada la investigación.
Tabla 1.
Resultados obtenidos en la caracterización del efluente
Parámetros |
Valores máximos permisibles |
Muestreo I |
Muestreo II |
Muestreo III |
Límites y rangos de detección |
|---|---|---|---|---|---|
| Temperatura °C | 50 | 28,70 | 28,60 | 28,40 | |
| Color (UC) | 20 | 15,00 | 20,00 | 20,00 | 5,0 – 70,0 |
| pH | 6 – 9 | 7,66 | 8,22 | 7,78 | 0,10 – 14,00 |
| Conductividad eléctrica (µS/cm) | 5 000 | 799,00 | 1 005 | 827,10 | 0,01 a 200 000 |
| Solidos T (mg/l) | 1500 | 670,00 | 701,00 | 615,00 | Hasta 20 000 |
| Solidos ST(mg/l) | 400 | 143,33 | 197,36 | 111 | Hasta 20 000 |
| Solidos Sed (ml/l) | 10 | 0,5 | 1,0 | 2,5 | 0,1 a 1 000 |
| Aceites y grasas totales (mg/l) | 100 | 11,93 | 23,27 | 22,84 | |
| Aceites y grasas minerales (mg/l) | 20 | N/A a | N/A a | N/A a | |
| DBO5 (mg/l) | 400 | 192,00 | 161,60 | 156,80 | 1,0 |
| DQO (mg/l) | 900 | 329,03 | 236,24 | 228,05 | 10,00 |
| Fósforo total (mg/l) | 12 | 3,12 | 5,561 | 5,08 | 0,25 |
| Nitrógeno total Kjeldahl (mg/l) | 60 | 23,32 | EMS b | EMS b | 1,00 |
| Mercurio (mg/l) | 0,02 | 0,00098 | 0,00351 | 0,00579 | 0,00009 |
| Manganeso (mg/l) | 10 | 0,10500 | 0,38200 | 0,07580 | 0,00116 |
| Arsénico (mg/l) | 0,5 | 0,00384 | 0,00175 | 0,00565 | 0,00099 |
| Cadmio (mg/l) | 0,75 | 0,0015200 | 0,00165 | 0,00094 | 0,00015 |
| Cromo6+ (mg/l) | 0,5 | <0,007 | <0,007 | <0,007 | 0,007 |
| Cobre (mg/l) | 3 | 0,0141000 | 0,02150 | 0,01150 | 0.00124 |
| Plomo (mg/l) | 1 | 0,0013400 | 0,04360 | 0,00647 | 0,00084 |
| Fenoles (mg/l) | 0,5 | 0,04 | 0,11 | 0,03 | 0,01 |
| Níquel (mg/l) | 3 | 0,00237 | 0,00154 | 0,00357 | 0,00028 |
| Zinc (mg/l) | 3 | 0,05640 | 0,25200 | 0,19600 | 0,03595 |
| Plata (mg/l) | 1 | 0,00231 | <0,00064 | <0,00064 | 0,00064 |
| Selenio (mg/l) | 1 | <0,00443 | <0,00443 | <0,00443 | 0,00443 |
| Sulfuros (mg/l) | 1 | 2,84 | 2,84 | 0,163 | 0,010 |
| Sulfatos (mg/l) | 500 | 35,32 | 45,28 | 35,62 | 0,25 |
| Hierro (mg/l) | 10 | 1,48 | 1,10 | 0,60 | 0,02 |
| Cloruros (mg/l) | 1 000 | 2,00 | 76,48 | 26,99 | 0,25 |
| Fluoruro (mg/l) | 10 | 0,92 | 0,885 | 0,81 | 0,25 |
| SAAM (mg/l) c | 3,580 | 5,760 | 4,280 | 0,01 |
a N/A: No analizado, dado que el laboratorio no cuenta con el método; b EMS: Equipo en mal estado; c SAAM: Sustancia activas al azul de metileno, análisis no estipulado en el reglamento pero considerado por el autor.
Los resultados expresados en la Tabla 1, en su mayoría cumplen con lo establecido de acuerdo con los análisis y procedimientos establecidos en el reglamento No. 21-2017 en el artículo 22; a excepción de los valores de Sulfuro Total siendo este el único parámetro que se encuentra por fuera del rango permisible obteniendo 2,84 mg/L de sulfuros de 1 mg/L permitido. Cabe señalar que las cantidades de sulfuro total reportadas se debe a la descomposición de la materia orgánica presente en el efluente de cada laboratorio, esto se vio reflejado en la inspección in situ siento este un problema latente para el centro.
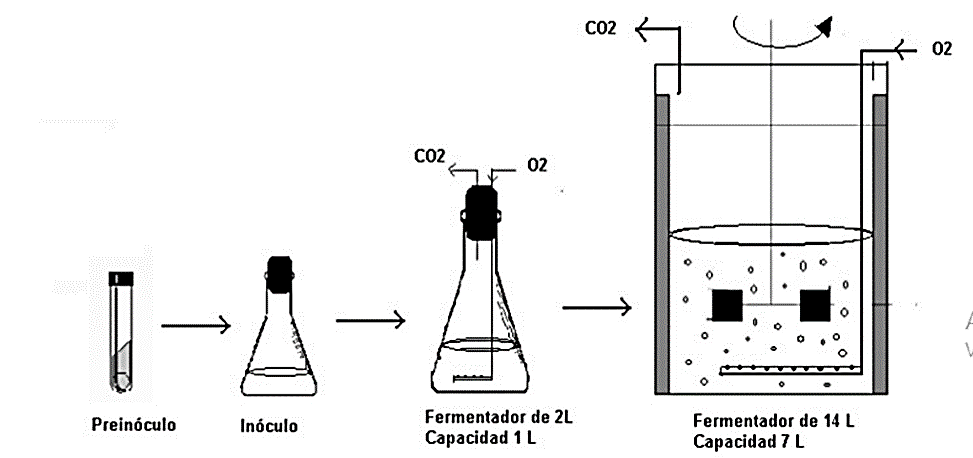
Figura 5. Desarrollo de inóculo, incremento del volumen de cultivo; fuente: (Rodrigo, 2015).
Con estos resultados se puede destacar la efectividad de los análisis, el cumplimiento de las gestiones de las aguas residuales y el compromiso del Centro por conocer y mejorar la calidad de las aguas residuales generadas en los procesos de los distintos laboratorios que conforman el CIRA/UNAN-Managua.
Desarrollo y crecimiento del inóculo
Para el crecimiento del inóculo a nivel escala de laboratorio fue necesario el uso de un reactor aireado de mezcla completa el cual permite un buen desarrollo de los microorganismos, el medio de cultivo donde serán generadas estas bacterias provienen del efluente secundario de un sistema de tratamiento de aguas residuales; es importante mencionar que aquellos efluentes con procedencias de solidos no bacterianas y grasas no pueden ser tomadas en consideración como medio de cultivo, ya que al presentar contaminación producirá interferencias no deseadas en el inóculo. El 19 de noviembre del año 2018, se inició la inoculación de las bacterias aerobias que fueron utilizadas en el ensayo.
El proceso de maduración del inóculo se ha desarrollado de manera que los microorganismos sean indispensables para el proceso de la biodegradación de la materia orgánica presente en el efluente en estudio. El volumen que se utilizó para el desarrollo del inóculo fue de 800 ml principalmente; luego se incrementó el volumen en 1 100 ml, se debe tener en cuenta que el volumen del medio puede ser mayor o menor según convengan o lo decida el investigador. Tal como se aprecia en la figura 5.
El reactor fue puesto en funcionamiento el 19 de noviembre del año 2018, agregando el medio de cultivo a dicho reactor con aireación continua 24/7. La alimentación con solución preparada a partir del peso de 20 g de leche en polvo descremada en 500 ml de agua destilada, comenzó el 20 de noviembre del año 2018; cabe mencionar que la concentración de la solución debe ser de 40g/L.
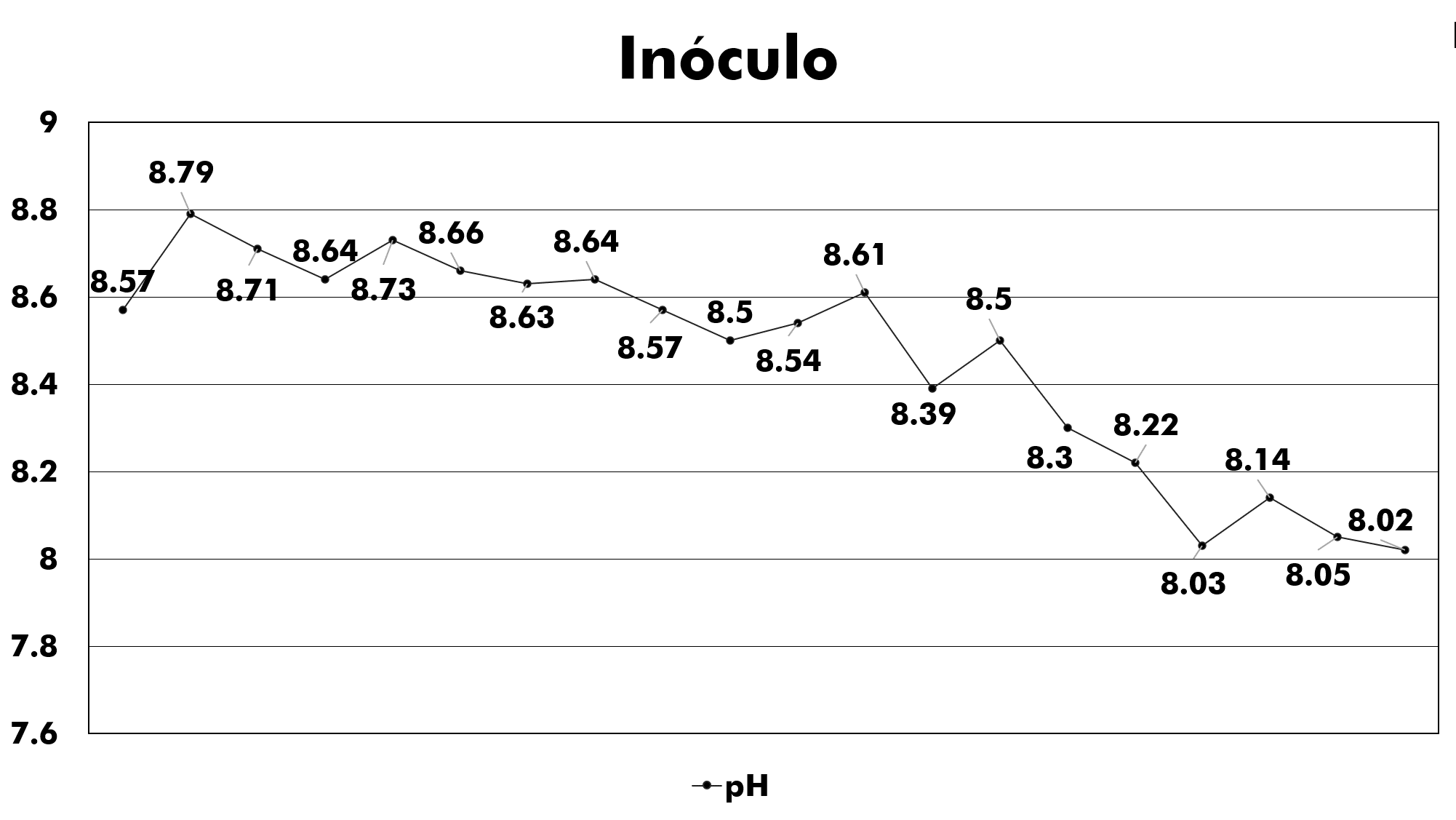
Figura 6: Medición del pH del inóculo.
Antes de cada alimentación se deben realizar la medición de parámetros de control como pH y Conductividad Eléctrica para conocer el comportamiento del inóculo. Tal como se muestra en la figura 6; el valor de pH fue en disminución por el incremento en la población del inóculo y la posible saturación del alimento.
Los datos de pH presentados en la figura 6, indican valores significativos para el desarrollo de las bacterias, por ende, no fue necesario el ajuste de dicho parámetro, ya que el pH óptimo del medio cultivo para el crecimiento de los microorganismos se debe encontrar entre 6,5 y 8,5 en unidades de pH. Sin embargo, la conductividad eléctrica fue en aumento, cabe mencionar que este parámetro no es necesario su determinación para desarrollar el inóculo, pero fue tomada en cuenta por parte del investigador como información extra dentro en el comportamiento de este parámetro.
Para la alimentación del inóculo se agregó 1 ml de leche por un lapso de aproximadamente 2 semanas, aumentando la cantidad del alimento dado a el incremento del consorcio y maduración, por lo que se estima su proporcionalidad, entre mayor sea la población mayor será su consumo. Pasando de un volumen de 1 ml a 10 ml del alimento en las últimas 3 semanas.
Se debe tener en cuenta las condiciones óptimas y parámetros para conocer que los microorganismos se encuentran listos para ser utilizado como inóculo, tal como se utilizan en el buen funcionamiento de los sistemas de tratamiento con lodos activados:
- pH: Este debe estar entre 6,5 y 8,5 unidades de pH
- Sólidos Suspendidos Volátiles (SSV): 2 500 mg/L
- Temperatura: 22 ± 4ºC
- Índice Volumétrico de Lodo (IVL): Debe ser menor a 150 mg/L
Método para la estimación de la biodegradabilidad del efluente
Una vez se obtengan los resultados dentro de las condiciones óptimas de los parámetros de SSV e IVL según lo establecido en el método, se procede al montaje del ensayo de biodegradabilidad; para esto se debe separar una porción de aproximadamente 200 ml del sobrenadante del inóculo, para retirar este es imprescindible que sea en días sin alimentación y someterlo a aireación de 3 a 5 días. Una vez finalizado el periodo de aireación (sin alimentación) el inóculo se encuentra listo para su respectiva utilización en la estimación de la biodegradabilidad; cabe señalar que, si se observa turbidez, se pueden someter el sobrenadante a filtración.
Es importante destacar que los ml de muestra y controles que serán adicionados en la botella Winkler están sujetos a los valores obtenidos en la Demanda Química de Oxígeno (DQO), por ende dicho análisis debe realizarse antes de comenzar el montaje del método., a su vez se debe determinar la DQO del control de acetato de sodio, donde el valor de DQO aproximado será de 420 mg/L; la concentración de DQO contenida en la Winkler por muestra y control según lo recomendado por la ISO 10707 y la guía OECD 301D es de 7.00 mg/L aproximadamente. La ecuación 7 (Ecuación de la dilución), presenta los cálculos para conocer los volúmenes adicionados en las botellas.
Ecuación de la dilución:
Dado que, el valor de DQO de la muestra fue de 252,3 mg/L y del control de acetato de sodio de 400,74 mg/L, los volúmenes adicionados a las botellas Winkler fueron de 8 ml (de la muestra) y 5 ml (control) respectivamente.
El volumen del sobrenadante o inóculo adicionado será de 1 ml, según lo descrito en el método de la ISO 10707 y la línea guía OECD 301D; para la preparación de cada de las muestras utilizadas en la estimación de la biodegradabilidad se distribuirán tal como se observa en la tabla 2.
Tabla 2.
Preparación de muestra y controles
Identificación |
Muestra |
Solución testigo |
Medio de ensayo |
Inóculo |
Agua |
Nº de |
|---|---|---|---|---|---|---|
| Muestra | X | _ | X | X | _ | 3 |
| CtrlH2ODes | _ | _ | _ | _ | X | 2 |
| H2ODil | _ | _ | X | _ | _ | 3 |
| CtrlEndo | _ | _ | X | X | _ | 3 |
| CtrlAce | _ | X | X | X | _ | 3 |
| CtrlInh | X | X | X | X | _ | 3 |
Una vez preparadas todas las botellas se procede a la primera lectura de Oxígeno Disuelto (OD) en cada réplica; realizando mediciones cada 7 días hasta culminar en el día 28, almacenando las Winkler en una incubadora a una temperatura constante en el rango de 20 ºC a 25 ºC; el OD será medido con una sonda conectada a un oxígenometro YSI 5001, este equipo que facilitará la lectura del parámetro.
Tabla 3.
Lecturas del OD de la muestra cada 7 días
Muestra |
t0 |
T °C |
t7 |
T °C |
t14 |
T °C |
t21 |
T °C |
t28 |
T °C |
|---|---|---|---|---|---|---|---|---|---|---|
| CtrlH2ODes | 5,70 | 19,92 | 5,74 | 19,70 | 5,60 | 19,88 | 5,45 | 19,58 | 5,30 | 19,51 |
| CtrlH2ODes | 5,79 | 19,76 | 5,76 | 19,81 | 5,58 | 19,59 | 5,40 | 19,60 | 5,32 | 19,54 |
| H2ODil | 7,95 | 19,83 | 7,78 | 19,57 | 7,65 | 19,94 | 7,54 | 19,57 | 7,46 | 19,38 |
| H2ODil | 7,95 | 19,70 | 7,77 | 19,74 | 7,65 | 20,09 | 7,58 | 19,48 | 7,48 | 19,29 |
| H2ODil | 7,97 | 19,55 | 7,79 | 19,67 | 7,62 | 20,13 | 7,55 | 19,43 | 7,47 | 19,20 |
| CtrlEndo | 7,95 | 19,20 | 7,07 | 19,92 | 6,80 | 19,46 | 6,47 | 19,46 | 6,52 | 19,33 |
| CtrlEndo | 7,94 | 19,21 | 6,96 | 20,03 | 6,60 | 19,43 | 6,24 | 19,41 | 6,60 | 19,39 |
| CtrlEndo | 7,96 | 19,32 | 7,07 | 19,79 | 7,01 | 19,51 | 6,68 | 19,53 | 6,65 | 19,34 |
| CtrlAce | 7,92 | 19,30 | 2,84 | 19,72 | 1,20 | 19,66 | 0,67 | 19,49 | 0,42 | 19,33 |
| CtrlAce | 7,92 | 19,36 | 2,71 | 19,79 | 1,32 | 19,73 | 0,87 | 19,46 | 0,69 | 19,27 |
| CtrlAce | 7,96 | 19,28 | 2,85 | 19,73 | 1,30 | 19,81 | 0,75 | 19,42 | 0,52 | 19,21 |
| Efluente final | 7,95 | 19,49 | 2,70 | 19,74 | 1,59 | 19,48 | 0,22 | 19,65 | 0,22 | 19,38 |
| Efluente final | 7,96 | 19,47 | 2,83 | 19,93 | 1,81 | 19,49 | 0,25 | 19,56 | 0,25 | 19,44 |
| Efluente final | 7,97 | 19,62 | 2,78 | 20,02 | 1,68 | 19,64 | 0,20 | 19,55 | 0,20 | 19,43 |
| CtrlInh | 7,95 | 19,59 | 1,91 | 19,81 | 1,27 | 19,59 | 0,13 | 19,47 | 0,10 | 19,43 |
| CtrlInh | 7,94 | 19,60 | 1,89 | 19,83 | 1,06 | 19,56 | 0,17 | 19,41 | 0,15 | 19,40 |
| CtrlInh | 7,97 | 19,62 | 2,03 | 19,83 | 1,21 | 19,60 | 0,50 | 19,35 | 0,10 | 19,30 |
La lectura del OD en las muestras que se muestra en la tabla 3, permite la realización del cálculo de la estimación de la biodegradabilidad última fácil del efluente final del CIRA/UNAN-Managua basado en los métodos de la ISO 10707 y la OECD 301D ambos métodos conocidos como pruebas de la botella cerrada.
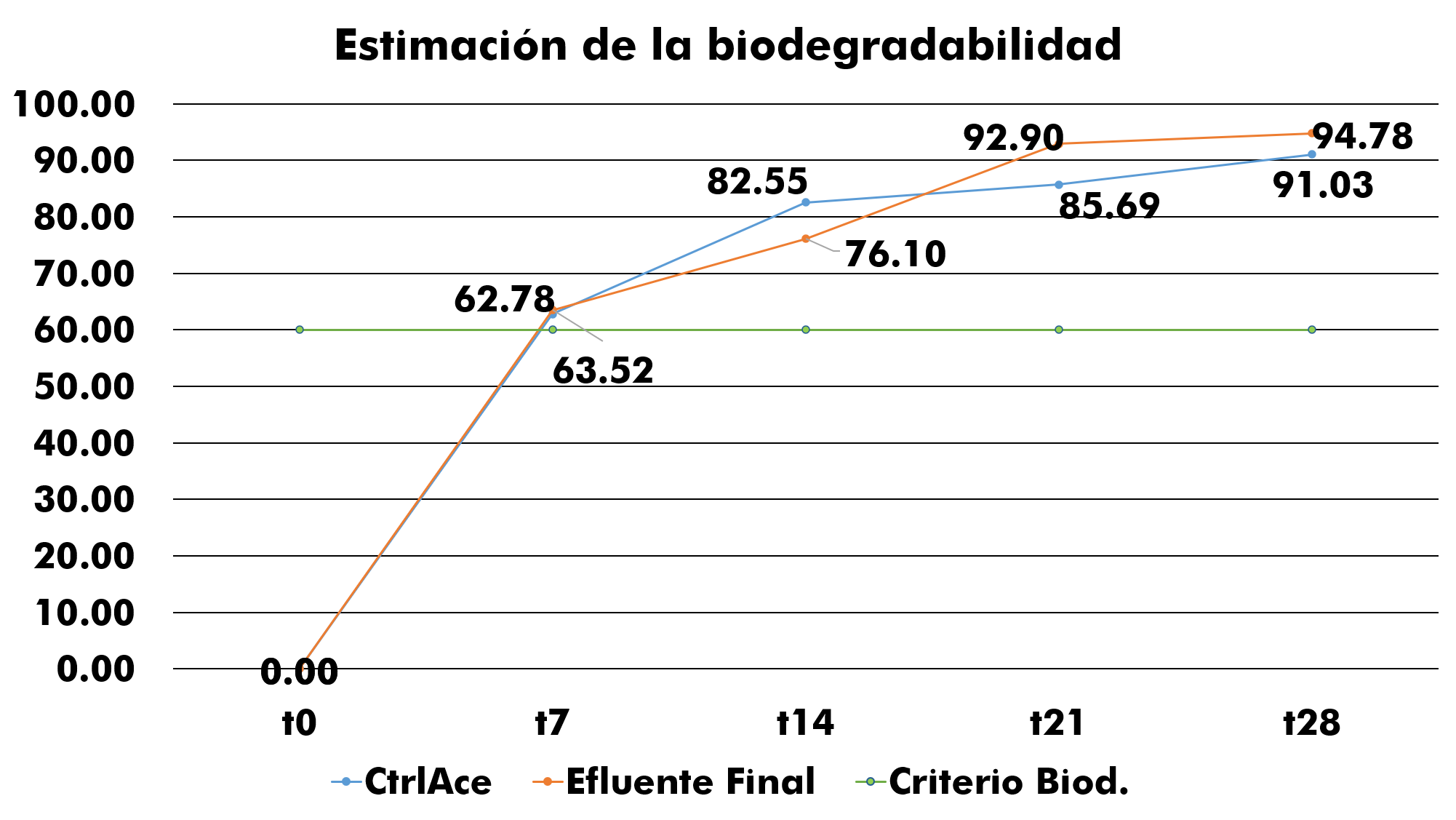
Figura 7: Representación de la estimación de la biodegradabilidad. Nota: Dado a la similitud en los datos en el t7 el valor del efluente es de 63,52% y del control de acetato es de 62,78%.
Se aprecia en la figura 7, el porcentaje final en la estimación de la biodegradabilidad del efluente siendo 94,78% biodegradable. A su vez es comparado con el control de acetato el cual es 91,03%, obteniendo de esta manera que el efluente final del CIRA/UNAN-Managua es fácilmente biodegradable.
La tendencia en aumento de la estimación o porcentaje de la biodegradabilidad que presenta el efluente, indica que el t14, cumple con el rango establecido en los métodos, donde los valores resultantes se encuentran por sobre el 60% de biodegradación, en el cual se explica a su vez que toda aquella materia fácilmente biodegradable estará presente en este punto; indicando también el aumento exponencial de la degradación hasta la obtención del 94,78% de biodegradabilidad, lo que da paso al cumplimiento del objetivo principal de la investigación.
Con lo que respecta a los controles, en el caso del control endógeno (CtrlEndo) se toman en consideración el medio de ensayo antes descrito más el inóculo; esto para conocer el porcentaje de biodegradación o consumo de oxígeno del medio o agua de dilución.
Para el estudio de la biodegradabilidad es imprescindible determinar el control de inhibición (CtrlInh) en el cual se ensayan tanto la muestra como el testigo, si la biodegradabilidad dada es menor al 25% según lo expresado en el método de la ISO 10707 y guía de la OEDC 301D, en base a la ThOD (Demanda teórica de oxígeno) o DQO, luego de los 14 días, entonces se debe asumir que la muestra es inhibitoria. Se debe repetir el ensayo usando una menor concentración de la misma. El control de inhibición presentó resultados donde no se detectó alguna sustancia que pueda inhibir el consumo de oxígeno en la muestra, interfiriendo en los resultados. Como se muestra en la figura 8.
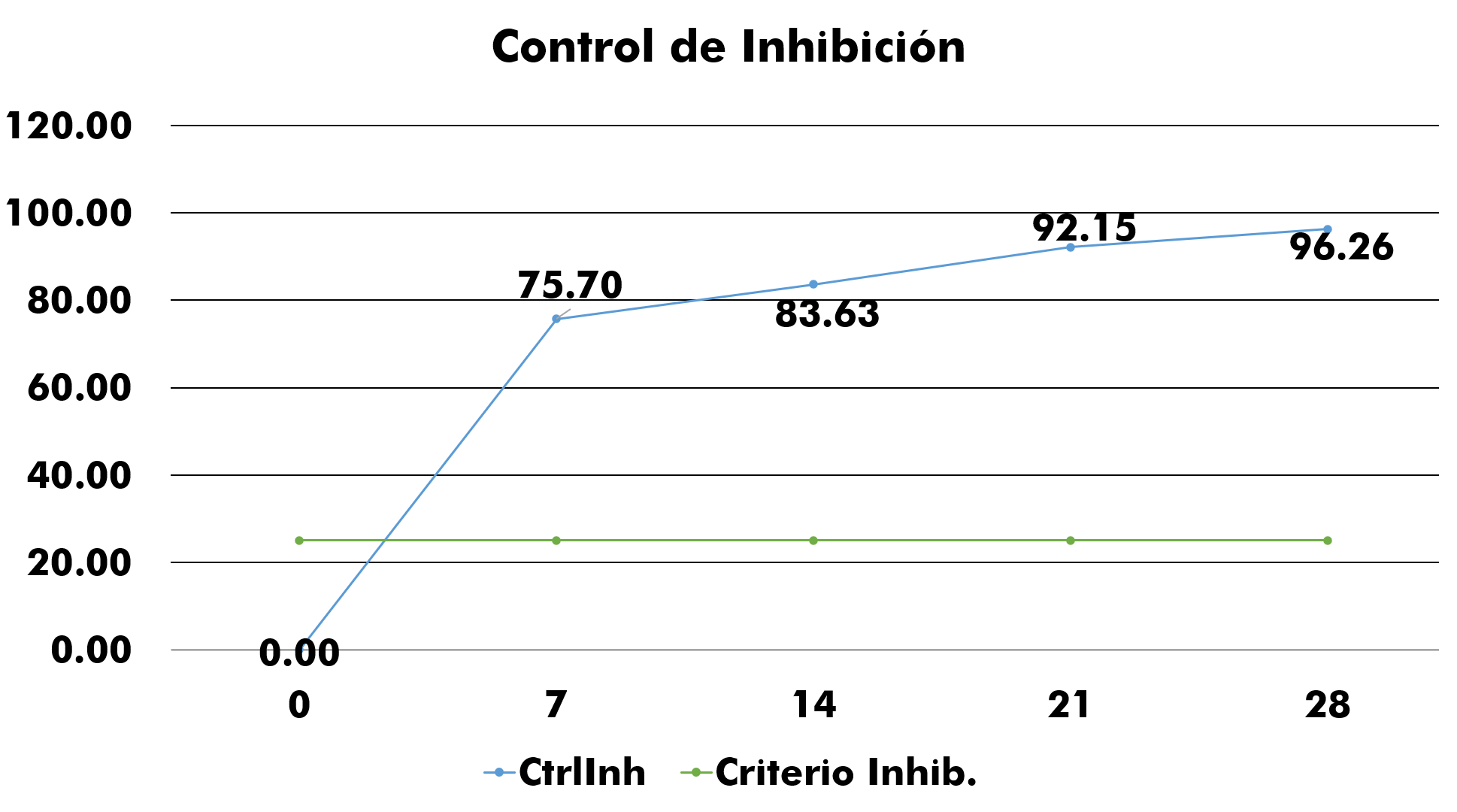
Figura 8: Criterio de inhibición
Para la obtención de la estimación del porcentaje de biodegradabilidad fue necesario de las siguientes ecuaciones:

Donde:
Dt: Porcentaje de Biodegradabilidad.
ρ0: Concentración de oxígeno, a tiempo cero (mg/L).
ρ0,t: Concentración de oxígeno, a tiempo final (mg/L).
ρ0,b: Concentración de oxígeno, a tiempo cero (mg/L). Control endógeno.
ρ0,t,b: Concentración de oxígeno, a tiempo final (mg/L). Control endógeno.
ThOD: Demanda teórica de oxígeno.
ρc: Concentración de la muestra.
CONCLUSIONES
El porcentaje de biodegradabilidad estimado para el efluente del CIRA/UNAN fue de 94,78 %, lo que demuestra que es un agua residual fácilmente biodegradable mediante el uso de microorganismos de origen aeróbicos, los cuales permitieron la degradación de la materia orgánica presente en el residual esto también conocido como biodegradabilidad última o fácil. Dando esta manera un avance para la implementación de un sistema de tratamiento biológico.
La calidad del agua del efluente de las aguas residuales del CIRA/UNAN-Managua, se encuentran dentro de los rangos máximos permisibles que establece el Reglamento No. 21-2017 en su artículo No. 22. Esto a pesar de no contar con el tratamiento de su efluente.
Se logró el desarrollo de un consorcio de microorganismos o inóculo que permitieron biodegradar la materia orgánica presentes en el residual, de esta manera determinar el porcentaje de la biodegradabilidad del efluente mediante biodegradación inducida; dicho inóculo fue generado a partir de las aguas proveniente de los sedimentadores secundarios de un sistema de tratamiento biológico, en un reactor a escala de laboratorio.
Existe un buen manejo de los residuos generados en cada laboratorio del CIRA/UNAN-Managua, esto se evidencia con el porcentaje de biodegradabilidad estimado según las metodologías de la norma de la ISO 10707 y línea guía de la OECD 301D.
BIBLIOGRAFÍA
Custodio Ruiz, A. (2008). Métodos y Técnicas de Invesigación Cienífica. México.
D. Eaton, A., S. Clesceri, L., W. Rice, E., & E. Greenberg, A. (2005). Standard Methods for the Examination of Water & Wasterwater. Washington, DC: American Public Health Association.
Gaceta, L. (30 de Noviembre de 2017). Decreto No. 21-2017. Reglamento en el que se establecen las disposiciones para el vertido de aguas residuales. Managua, Nicaragua.
ISO. (1999). ISO 9888:1999. En Water quality — Evaluation of ultimate aerobic biodegradability of organic - Static test (Zahn-Wellens method). Genève, Switzerland: Switzerland.
Kaiser. (1998). Review of biodegradability. Water Qual. Res. J. Canada, 85-211.
Laboratorio de Aguas Residuales. (2009). Procedimiento Operativo Normalizado. Managua: CIRA/UNAN-Managua.
Metálicos, L. d. (2019). Manual de Procedimientos Operativos Normalizados. Managua: CIRA/UNAN-Managua. Nicaragua.
OECD. (17 de Julio de 1992). OECD 301. Linea guía para pruebas de productos químicos. OECD.
Ottenbrite, & Albertsson. (1992). Discussion on degradation terminology: Biodegradable Polymers and Plastics. The Royal Society of Chemistry Cambridge, RU, 73-92.
Peña, D. (2013). Determinación de la relación DQO/DBO5 en aguas residuales.
Pocovi. (2003). Investigación cualitativa: Una alternativa viable. ITESO. México.
Residuales., L. d. (2019). Procedimiento Operativo del Aseguramiento y Control de la Calidad para la Medición del Caudal de Aguas Residuales y Naturales. Managua: CIRA/UNAN-Managua. Nicaragua.
Rodrigo, Y. (2015). Desarrollo y manejo de inóculos. Trujillo. Facultad de Ciencias Biologicas.
Tamayo Tamayo, M. (2002). El Proceso de la Investigación Científica. México: LIMUSA, S.A.
Vazquez Rodriguez, G., & Beltrán Hernández, R. I. (Enero de 2004). Pruebas Normalizadas para la Evaluación de la Biodegradabilidad de Sustancias Químicas. Estado de Hidalgo, México.
W. Rice, E., B. Baird, R., D. Eaton, A., & S. Clesceri, L. (2012). Standard Methods for the Examination of Water and
Wastewaster, 22ND Edition. Baltimore: American Public Health Associatons.
© 2021 Revista Científica de FAREM-Estelí.
![]() Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.

