Primer taller “calidad de la toma de papel filtro” para vigilancia molecular del Plasmodio
First workshop “quality of filter paper collection” for molecular surveillance of Plasmodium
Betzabé Mara Rodríguez1
betzamara@gmail.com
Recibido: 28 de marzo de 2020, Aceptado: 29 de junio de 2020
1 Centro Nacional de Diagnóstico y Referencia. Ministerio de salud de Nicaragua. Orcid: https://orcid.org/0000-0003-2932-1126
RESUMEN
En Nicaragua la malaria continúa siendo un problema de salud pública, en 2005 se establecieron sitios centinelas en las zonas afectadas del país donde se vigila la fármaco resistencia del Plasmodium falciparum y se evalúa la dinámica del Plasmodium vivax. Para esto se incorporó la toma de sangre en papel filtro en pacientes con paludismo confirmado por microscopia. Dada la importancia del procedimiento de toma de muestra, se hizo necesaria una capacitación integral y periódica en dos rondas (septiembre-noviembre 2016), al personal de salud, tanto del sector estatal como privado de zonas de alta y baja endemia del caribe y occidente de Nicaragua, para mejorar la calidad de la toma de muestra se incorporaron procedimientos operativos estandarizados (POEs), 20 microscopistas fueron entrenados, procedentes de estos sitios centinelas, con la que se incorporaron técnicas y materiales para mejorar los indicadores que garantizan una buena muestra para evaluaciones moleculares, la aceptación de estos procedimientos por parte del personal de salud ha logrado un impacto en la calidad de la muestra hemáticas en papel filtro para los estudios de vigilancia que el país lleva.
Palabras claves: plasmodio; vigilancia; fármaco resistencia.
ABSTRACT
In Nicaragua, malaria is still a public health problem; in 2005, custodian sites were established in the affected areas of the country where the medication resistance of Plasmodium falciparum is monitored and the dynamics of Plasmodium vivax are evaluated. For this purpose, blood test was taken on filter paper in patients with malaria confirmed by microscopy. Given the importance of the sampling procedure, a comprehensive and periodic training was necessary to develop in two rounds (september - november 2016), to the health employees, both from the state and private sectors of high and low endemic areas of the caribbean and the west area of Nicaragua. In order to improve the quality of sampling, standardized operating procedures (SOPs) were incorporated, 20 microscopists were trained, from these sentinel sites, with which techniques and materials were incorporated to improve the indicators that guarantee a good sample for molecular evaluations, the acceptance of these procedures by health employees has achieved an impact on the quality of the blood sample in filter paper for the surveillance studies that the country has.
Keywords: Plasmodium; surveillance; drug resistance.
INTRODUCCIÓN
De las enfermedades tropicales, la malaria, es la de mayor prevalencia a nivel mundial (MINSA, 2013). Es causada por parásitos del género plasmodio que se transmiten de una persona a otra a través de la picadura de una mosquita del género Anopheles. (OMS, 2015). En Centroamérica el plasmodio que más predomina es el Plasmodium vivax (95%), el resto corresponde a Plasmodium. falciparum, encontrándose casos esporádicos de Plasmodium malarie (Rodríguez y Betanzos-Reyes, 2011).
El plasmodio puede ser detectado a través de un examen microscópico llamado gota gruesa con un límite de detección mínimo de 50 parásitos por micro litro de sangre, en bajas parasitemias (Ferreira y Castro, 2013). Muchos países han reportado cambios en la genética del parásito que la microscopía no puede evidenciar, pudiendo provocar resistencia a los medicamentos que se tienen (OPS, CDC, USAID, 2010).
Venkatachalam, Barnwell, Macedo de Oliveira, (2013), en su informe ejecutivo de la vigilancia molecular, plantean que los cambios o formulación de las políticas de tratamientos de los países, son sustentados por los estudios de eficacia terapéutica in vivo.
OPS 2018, en su manual de referencia para la vigilancia de la malaria, expresa que lastécnicas moleculares para identificar marcadores de fármaco resistencia u otros aspectos genéticos del plasmodio, constituyen una herramienta valiosa para monitorear al parásito, sobre todo en países donde hay pocos casos como para conducir estudios in vivo y no tienen un sistemas de vigilancia sólido, para esto es necesario contar con una muestra de sangre en papel filtro de los casos confirmados de malaria,.
En Nicaragua para monitorear estos cambios genéticos en el parásito, se ha tomado sangre en papel filtro desde el 2005(Venkatachalam et al 2013).
En 2005 se establecen seis sitios centinelas para la vigilancia de la fármaco-resistencia del P. falciparum, ubicados en la costa caribe norte de Nicaragua (Puerto Cabeza, Waspan, Prinzapolka, Siuna, Rosita y Bonanza) en el 2010 se incorporan cuatro municipios de una zona endémica de P. vivax Chinandega, Chichigalpa, El Viejo y Somotillo (MINSA 2013).
OMS, 2015, plantea en su documento, Estrategia técnica mundial contra la malaria 2016-2030, las herramientas que se tienen para evidenciar de cambios a nivel genético del parásito pueden ayudar a que el país realice cambios en las políticas de intervención, esquema de tratamiento, tipo de medicamentos así como el tipo de pruebas rápidas que se utilizan en el país, con vías a la eliminación.
Nicaragua con financiamiento de organizaciones como AMI/RAVREDA, OPS/OMS y CDC, realiza vigilancia de la fármaco-resistencia del P. falciparum a los sitios centinelas, quienes son los que aportan la mayor carga de la enfermedad al país (Venkatachalam et al 2013).
El objetivo principal de este taller fue mejorar la calidad de la toma de muestra hemática en papel filtro bajo procedimientos operativos estandarizados (POEs), a través de una capacitación al personal de salud de la red diagnóstica del Ministerio de Salud (MINSA) y laboratorios privados de los sitos centinelas.
La capacitación continua en la toma de muestras hemáticas en papel filtro para realizar estudios moleculares de la malaria puede ser una de las herramientas principales para garantizar la calidad de la fase pre analítica para estudios de tan alta sensibilidad, la muestra en papel filtro, además de los beneficios de romper con la red de frio, que muchos países como el caso de Nicaragua, eleva los costos en zonas donde el acceso es una limitante y que además son zonas endémicas de malaria.
MATERIALES Y MÉTODOS
Se realizó un estudio descriptivo de corte transversal retrospectivo de la experiencia obtenida después de las capacitaciones al personal de salud en la preparación del papel filtro, toma de muestra, manejo y envío de muestras hemáticas positivas a P. falciparum y P. vivax, para estudios moleculares de resistencia y dinámica de población en el plasmodio durante el año 2016.
Población y área
la capacitación estuvo dirigida a microscopistas responsables de laboratorios regionales de los sistema local de atención integral en salud (SILAIS) y el sector privado de estas mismas zonas, donde se monitorea molecularmente los plasmodio: P. falciparum y P. vivax.
Los microscopistas fueron seleccionados por ser los responsables de diagnosticar la malaria en zonas endémicas de paludismo y de mucho tránsito debido a razones económicas o de migración, a estas zonas se les denominó sitios centinelas por el Ministerio de Salud.
Estos sitios centinelas se encuentran dentro de los SILAIS que es una organización administrativa del Ministerio de Salud para llevar la administración de todo el sistema de salud y la información que generan.
La implementación de sitios centinela en Nicaragua se inicia en el 2005 con el objetivo de vigilar en zonas endémicas de P. falciparum la presencia de cepas que presenten mutaciones asociadas con resistencia a la chloroquina y primaquina, mediante la vigilancia molecular, debido a que muchos países habían reportado esta situación y además porque en el país este es el tratamiento de primera línea para la cura de la malaria.
Ubicación de las zonas para capacitación y sus características (personal e infraestructura)
Los SILAIS con sitios centinelas fueron de tres zonas de Nicaragua, dos de ellas donde la malaria es endémica, ubicada en el la región Atlántico norte y sur del País (SILAIS Bilwi y SILAIS Las Minas), donde se vigila al P. falciparum, Estas zonas se caracterizan por tener poblaciones ricas en diversidad étnica y ser zonas fronterizas donde los habitantes presentan una movilidad activa y sin control por parte de los dos países (Honduras y Nicaragua). Una tercera zona ubicada en occidente del país (SILAIS Chinandega) en una zona de baja endemicidad, pero con una actividad económica fuerte, donde se monitorea la dinámica del P. vivax. En las zonas fronterizas de este SILAIS se observa migración de personas procedentes de América de sur u otros continentes (África y Asia). (Fig. 1)
Figura 1. Ubicación de los sitos centinelas para la vigilancia molecular del plasmodio en Nicaragua
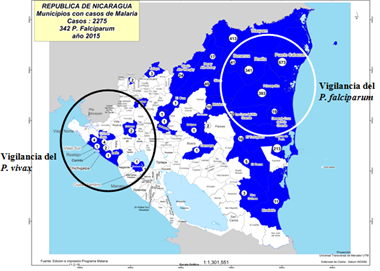
Fuente: Dirección de vigilancia Ministerio de Salud
Bases de la capacitación: Se utilizó como base de la capacitación el procedimiento estandarizado (POE) que el Centro Nacional de Diagnóstico y Referencia (CNDR) elaboró para facilitar la toma de muestra hemática en papel filtro basado en guías de OMS/OPS.
Selección del Personal para la capacitación (responsabilidades, capacidades): Se seleccionó para esta capacitación personal encargados de la toma de muestra hemática en papel filtro a pacientes que resultan positivos en gota gruesa para P, falciparum o P. vivax, el responsable del diagnóstico de malaria en el área de laboratorio y el responsable del laboratorio del SILAIS o de los laboratorios privados.
El responsable del laboratorio debe garantizar que todos los laboratoristas que están a su cargo deben saber tomar la muestra para este fin, así como el embalaje de esta para que sean enviadas al CNDR donde es el lugar de recepción.
Los laboratorios de los SILASI, municipios y laboratorios privados tienen a un responsable que es un Bío-analista y los tomadores de muestras van desde personal con entrenamiento básico en toma de muestra hemática y otros fluidos o flebotomista hasta un Bío-analista.
Fases de la capacitación
Teórica epidemiológica: Se impartió charla teórica donde se explica la importancia de la etapa pre analítica en la toma de muestras hemáticas siguiendo normas de bioseguridad y procedimientos operativos estandarizados (POEs) y se dieron a conocer los resultados de los estudios de susceptibilidad a los anti-maláricos que hasta la fecha se habían llevado en Nicaragua, siendo la base fundamental de estos estudios la calidad de las muestras que ellos toman.
Teórico-demostrativo- práctico: Se dio a conocer la importancia de la preparación del papel filtro y los procedimientos para poner la muestra hemática, a través de una demostración, se les enseño el cuido y manejo del papel filtro y la forma correcta de impregnar la sangre en el papel filtro y la toma de la gota gruesa (prueba de oro en el diagnóstico de la malaria) y debe siempre ser acompañada con el papel filtro, la que también se impartió en la demostración como parte del refrescamiento ya que eran microscopistas con experiencia en esta área.
Se les mostró, cómo se realiza la correcta identificación del papel filtro y la gota gruesa la que tiene que corresponder con los cuadernos de registro de muestras de malaria del SILAIS, para cumplir con las normas de trazabilidad de la muestras dentro de los parámetros de la gestión de calidad y se finalizó con los métodos de embalaje de la muestra para su envío y correcta conservación para los procedimientos moleculares.
Evaluación practica: A cada microscopista se le asignó la tarea de preparar el papel filtro siguiendo todos los procedimientos operativos estandarizados (POEs), la impregnación del papel y preparación de la gota gruesa con sangre colectada de voluntarios dentro del grupo, siguiendo las normas de bioseguridad en el manejo de muestras hemáticas, así como la identificación y el embalaje de estas, siguiendo los parámetros de calidad. Se evaluó el cumplimiento de todos los procedimientos y normas en la obtención de pruebas hemáticas en papel filtro con calidad para el diagnóstico molecular.
Duración de los talleres: Los talleres tuvieron una duración de tres días y se realizó en dos rondas, estas giraron en torno a los buenos procedimientos de la toma hemática en papel filtro, usando los POEs adaptados por el CNDR para que sirvan de guía, tanto en la toma de muestra, preservación y envío, así como para que sean incorporado a los sistemas de gestión de la calidad y capacitación de los laboratorios de municipios de los SILAIS (Fig. 2)
La primera ronda de capacitación se realizó en septiembre del 2016 en el laboratorio regional de los SILAIS de los 10 sitios centinela: SILAIS Bilwi (Puerto Cabeza, Prinzapolka y Waspan), SILAIS Las Minas (Bonanza, Siuna y Rosita) y SILAIS Chinandega (Chinandega, Chichigalpa, El Viejo y Somotillo).
La segunda ronda de capacitación se realizó a finales de octubre del 2016 en los mismos SILAIS pero esta vez se contó con la participación de los laboratoristas de los municipios, personal de nuevo ingreso a los laboratorios de la red diagnostica del MINSA y laboratorios privados, siguiendo la misma guía de la primera capacitación, esta fue impartida casi en el 90% por los responsables de laboratorios y acompañados por los especialistas del CNDR-MINSA, mucho del cual fue impartido en misquito, idioma de algunas de las zonas donde se realizó esta.
Figura 2. Laboratoristas entrenándose en la preparación, manejo y toma de muestra en papel filtro procedentes de todos los SILAIS del país
Fuente: Elaboración propia
Periodicidad: Replicar estos talleres dos veces al año a los microscopistas de cada municipio de su SILAS orientados a la buena toma de muestra hemática en papel filtro basados en los POEs que el CNDR entregó para dar cumplimiento a los compromisos del SILAIS con el componente de malaria del Ministerio de Salud del país
Materiales y almacenamiento: El hospital, centro de salud o el puesto de salud donde es captado el caso positivo por microscopia cuenta con materiales para la toma de muestras: láminas algodón, alcohol 70%, lancetas y papel filtro.
Para el almacenamiento del papel filtro se le se les entrega bolsas plásticas tipo Zipploc con cierre zipper y secantes, este último se les recomienda tener en condiciones secas, protegido del polvo y el calor.
Obtención, identificación manejo y envío de la muestra hemática en papel filtro: Una vez que el paciente es confirmado por gota gruesa como positivo o de ser un caso de malaria a través del diagnóstico microscópico, se le explica la necesidad de tener su consentimiento para tomarle una muestra hemática en papel filtro que consiste en dos gotas de sangre independientes que son depositadas en el papel al dejarla caer desde el dedo, previamente limpio con alcohol, hasta el papel filtro por gravedad de forma que el dedo del paciente no toque el papel, para evitar que interfiera con los procesos moleculares con fines de vigilancia, el consentimiento queda registrado en los SILAIS o las unidades donde se toma la muestra.
La muestra se rotula con el código de la gota gruesa en la que resultó positiva, que tiene como guía, la clave del laboratorio del municipio, el código de la unidad de salud y, así como el número que le fue asignado al paciente y que es consecutivo en la asignación de estos casos, además son registrado en el sistema de información de vigilancia epidemiológica (SIVE) y en los formatos M10 con los cuales se investiga el caso positivo en el país.
Esta muestra hemática en papel filtro una vez seca es embalada en una bolsa plástica tipo¨Zipploc¨, mantenida a resguardo de la luz con secante y almacenada a temperatura ambiente hasta su envió al laboratorio central del MINSA.
La muestra se recepciona en el laboratorio de referencia del nivel central CNDR, a través de entrega directa del SILAIS al laboratorio de referencia de malaria, aquí se encarga de almacenarla y clasificarla ubicándolas por sitio centinela y se verifica el diagnóstico de la gota gruesa enviada con el papel filtro.
Una vez preparadas se embalan para el envío al laboratorio supra regional ubicado en Honduras, donde se realiza la evaluación molecular de la fármaco resistencia a los casos positivos a P. falciparum y luego se les realiza control de calidad en los laboratorios del CDC Atlanta USA, el papel filtro de los positivos para P. vivax, son enviados a los laboratorios de referencia en malaria del Instituto de Salud Pública de Tapachula México para la vigilancia de la dinámica de población a través de las variantes del plasmodio, flujo que fue acordado por OPS y los representantes de cada país, para optimizar los reactivos para estos estudios moleculares.
RESULTADOS Y DISCUSIÓN
20 Microscopistas fueron capacitados en la preparación de las muestras hemáticas en papel filtro, bajo procedimientos estandarizados para obtener una muestra con suficiente material hemático y de excelente calidad para los análisis moleculares.
Se les capacitó en el método de preparación de papel filtro, para que manejaran los cuidados que se debe tener en la preparación, almacenamiento, toma de muestra y manejo del papel filtro así como la correcta identificación.
Dentro de la capacitación se hizo hincapié en obtener sangre a partir de punción capilar para poner en el papel filtro y se demostró con láminas de gota gruesa, los daños que el anticoagulante puede hacer al parásito y por ende al material genético de este, con el fin de evitar que tomen muestra venosa con anticoagulante.
La calidad de la toma de muestra se evaluó por dos aspectos 1) morfológicos: toma de muestra, llenado de la gota de sangre en el circulo de referencia, ausencia de huellas dactilares en la muestras de sangre , ausencia de hongos u otros artefacto en la gota de sangre, desprendimientos de la gota, humedad de la muestra 2) identificación: estos tienen que ver con la correcta codificación de la muestra debe contener la identificación del SILAIS y del sitio centinela así como el numero único con el que se registra al paciente.
Durante el mes de octubre posterior a la capacitación, se observó un 100% de mejoría en la calidad de sangre colectada en el papel filtro, identificación de la muestra y embalaje, en contraste con meses anteriores donde teníamos algunas muestras que no fueron aptas para procedimientos moleculares.
Se evaluó la percepción del los participantes de forma verbal, sobre el taller del que dijeron sentirse complacidos porque nunca habían recibido un taller de este tipo y lo importante de dar este tipo de entrenamiento en su idioma, debido a que ellos no hablan español como lengua nativa y esto hace la limitante de interpretación al capacitar personal que rota o personal nuevo.
CONCLUSIONES
Capacitar a los especialistas de laboratorio, sobre la importancia de la correcta toma de muestra fue un paso decisivo en la garantía de la calidad de muestras para estudios como vigilancia molecular de la fármacoresistencia y más aun cuando ellos logran empoderarse de la gran responsabilidad que el país deja en sus manos.
La vigilancia de la fármacoresistencia ha sido de gran importancia para el país, porque se continua manejando el esquema tradicional de chloroquina y primaquina, detectar la presencia de cepas resistentes circulando en el país, generaría cambios en este esquema, así como intervenciones epidemiológicas con el fin de lograr la contención de estas cepas para evitar su distribución en el país.
Capacitar resulta coste efectivo, porque además de que se motiva al personal de salud al sentirse actualizados, ellos expresan su gran voluntad de apoyar, cuando están bien entrenados en los aspectos básicos se reduce el número de muestras rechazadas por no ser aptas para evaluaciones moleculares. Un beneficio adicional en este taller fue incluir en la capacitación al sector privado, ya que también ellos captan casos, de forma que el MINSA puede tener un inventario de capacidades del sector privado.
Otro beneficio es romper con la red de frio, al hacer toma de muestra hemática en papel filtro se reduce los costo de la vigilancia sobre todo en zonas donde el acceso es una limitante, este procedimiento ha venido a dar la posibilidad de mantener un banco de muestras de bajo costo y alta calidad.
Con los cursos que los responsables de laboratorio impartieron se puedo evidenciar y evaluar el domino de los responsables de laboratorio de los SILAIS en cuanto a los procedimientos en general y ver las debilidades de cada unidad, con miras a fortalecerlas.
Además ha brindado la oportunidad de tener una matriz con los que se podría hacer estudios genéticos, como dinámica de migración de parásitos resistentes, su evolución, así como la vigilancia en las zonas donde no son factibles los estudios terapéuticos in vivo.
REFERENCIAS
Ferreira, Marcelo y Castro Marcial (2013): Situación de la Malaria en Latino América y el Caribe: trasmisión Residual y resurgente desafíos para el control y la eliminación, Methods Mol Biol. 2019; 2013:57-70. doi: 10.1007/978-1-4939-9550-9_4.
Ministerio de Salud de Nicaragua, MINSA, (2013). N-114 Norma Nacional para la prevención control y tratamiento de la malaria. Recuperado de:
http://www.minsa.gob.ni/index.php/component/remository/Descargas-MINSA/Direcci%C3%B3n-General-de-Regulaci%C3%B3n-Sanitaria/Normas-Protocolos-y-Manuales/Normas-2013/orderby,4/page,2/?Itemid=0
Organización Panamericana de la salud, (OPS), Centro de Control de Enfermedades, (CDC) y Agencia Americana para el Desarrollo Internacional, USAID, (2010). Guía práctica revisada para estudios de eficacia de los medicamentos antimaláricos en las Américas Recuperado de https://www.paho.org/hq/dmdocuments/2011/modificada-PAN-JUL-2010-integrada-2011.pdf?ua=1
Organización Mundial de la Salud, OMS, (2015). Reporte Mundial de Malaria. Recuperado de https://www.who.int/malaria/publications/world-malaria-report-2015/report/en/ ISBN: 978-92-4-156515-8
Organización Mundial de la Salud. (2015). Estrategia técnica mundial contra la malaria 2016-2030. Recuperado de https://apps.who.int/iris/handle/10665/186671 ISBN 9789243564999
Organización Panamericana de la Salud (OPS) 2018: Manual de referencia para la vigilancia, el seguimiento y la evaluación de la malaria, Recuperado de
http://iris.paho.org/xmlui/handle/123456789/50648 ISBN 978-92-75-32056-3
Rodríguez, Mario Henry, & Betanzos-Reyes, Ángel Francisco. (2011). Plan de mejoramiento del control de la malaria hacia su eliminación en Mesoamérica. Salud Pública de México, 53 (Supl.3),s333-s348.Recuperado http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0036-36342011000900007&lng=es&tlng=es. S0036-36342011000900007
Venkatachalam, K., Barnwell, J.W., Macedo de Oliveira, A. (2013).¨Vigilancia molecular de la resistencia de Plasmodium falciparum a los antimaláricos (de 2005a2012) informe Ejecutivo. Recuperado de https://www.paho.org › Molecula-Surv-Plasmodium-2005-2012-Spa
© 2020 Revista Científica de FAREM-Estelí.
![]() Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
