Estructura de comunidades de murciélagos como bio-indicadores del hábitat en la Reserva Biológica Indio Maíz
Structure of bat communities as habitat bio-indicators in the Biological Reserve Indio Maiz
Denry Martínez Gómez1
dedmartz1@gmail.com
Dumar González Lazo2
q.dumar@yahoo.es
Octavio Antonio Saldaña Tapia3
pcmnicaragua@gmail.com
Juan Asdrúbal Flores-Pacheco4
asdrubal.flores@do.bicu.edu.ni
Recibido: 18 de mayo de 2020, Aceptado: 30 de junio de 2020
1 Facultad de Recursos Naturales y Medio Ambiente, Bluefields Indian & Caribbean University- BICU, Apartado postal N° 88, Avenida Universitaria, Bluefields, Nicaragua. Programa Conservación Murciélagos Nicaragua – PCMN. Orcid: https://orcid.org/0000-0002-6113-0357
2 Facultad de Recursos Naturales y Medio Ambiente, Bluefields Indian & Caribbean University- BICU, Apartado postal N° 88, Avenida Universitaria, Bluefields, Nicaragua. Programa Conservación Murciélagos Nicaragua – PCMN. Orcid: https://orcid.org/0000-0002-3879-5406
3 Programa Conservación Murciélagos Nicaragua – PCMN. Orcid: https://orcid.org/0000-0003-0136-1222
4 Facultad de Recursos Naturales y Medio Ambiente, Bluefields Indian & Caribbean University- BICU, Apartado postal N° 88, Avenida Universitaria, Bluefields, Nicaragua. Programa Conservación Murciélagos Nicaragua – PCMN. Orcid: https://orcid.org/0000-0001-6553-7202
RESUMEN
Los murciélagos son indispensables para la polinización de cultivos, el control de insectos y de plagas agropecuarias y humanas que pueden ser vectores de zoonóticas. Sin embargo, se desconoce cuál es el estado de las comunidades y estructura biológica de estos en la Reserva Indio Maíz, que a su vez funcionan como bioindicadores de conservación de agroecosistemas. Para este fin se caracterizaron los agroecosistemas de la reserva. Se utilizaron redes de niebla para la captura de especímenes registrando peso, tamaño y estado sexual. Se identificaron taxonómicamente por agroecosistema. La comparación entre estos es resultado de los índices de biodiversidad y similitud. Se capturaron 384 individuos y 39 especies distribuidas en ocho familias y cinco subfamilias. El 71% del total de individuos se encuentran en un buen estado de salud. El índice de Shannon indica que el bosque húmedo fue el más alto de todos los agroecosistemas. La subfamilia Phyllostominae fue más representativa en cuanto a especies. Esta familia aparece con la más representatividad en cuanto a especies que se distribuyen de manera equitativa. Esto concuerda con otros estudios realizado sobre la familia de los Phyllostomidae ya que estos grupos de animales son más intolerantes a perturbación de hábitat.
Palabras claves: Quiróptero; perturbación ambiental; estabilidad de agroecosistema; biodiversidad.
ABSTRACT
Bats are indispensable for the pollination of crops, the control of insects and of agricultural and human pests that can be zoonotic vectors. However, the status of the communities and their biological structure in the Indio Maíz Reserve, which in turn function as bioindicators of agroecosystem conservation, is unknown. For this purpose, the agroecosystems of the reserve were characterized. Fog nets were used to capture specimens recording weight, size, and sexual status. They were taxonomically identified by agroecosystem. The comparison between these is the result of the biodiversity and similarity indices. 384 individuals and 45 species distributed in eight families and ten subfamilies were captured. 71% of all individuals are in good health. The Shannon rain forest index was the highest of all agroecosystems. The Filostomidos subfamily was more representative in terms of species. This family appears with the most representativeness in terms of species that are distributed equally. This agrees with other studies carried out on the Phylostomid family since these groups of animals are more intolerant to habitat disturbance.
Keywords: Chiropter; environmental disturbance; agroecosystem stability; biodiversity.
INTRODUCCIÓN
Las actividades humanas modifican la composición de las comunidades de los vertebrados propios de un lugar, por lo que la fauna original puede ser erradicada por completo. Sin embargo, cuando a la regeneración natural se le permite tomar su lugar, el área que fue alterada sufre un proceso de sucesión paralela entre comunidades de plantas y animales. Esta regeneración del bosque envuelve procesos ecológicos y evolutivos que actualmente están atrayendo la atención de un creciente número de científicos. Su entendimiento es un punto de vital interés el cual podría constituirse en una de las más importantes áreas de estudio en la conservación de los ecosistemas tropicales (Flores-Saldaña, 2008). Recientemente los murciélagos han sido utilizados en investigaciones sobre la regeneración del bosque, ya que son los únicos mamíferos que disfrutan de una movilidad comparable, por lo que su habilidad para volar los hace también valiosos en el estudio del impacto de la deforestación y otros tipos de alteraciones producidas por la acción del hombre, a corto y largo plazo (Charles-Dominique, 1986; Fenton et al., 1992; Fleming, 1986).
En Nicaragua los murciélagos son el grupo de mamíferos mejor representados, con un registro de 111especies que corresponde al 47% del total de la fauna mastozoológica (Medina et al., 2019; Saldaña et al., 2020). Los murciélagos se caracterizan por ser los únicos mamíferos voladores en el mundo, esta capacidad les otorga una amplia movilidad en los ecosistemas, que los hace responder de manera distinta ante diferentes estructuras de paisajes (Gorresen & Willig, 2004; Jaberg & Guisan, 2001; Medina, Harvey, Sánchez, Vílchez, & Hernández, 2007). Los murciélagos utilizan una gran variedad de hábitat como refugio y como fuente de alimentación. Presentan distintos gremios alimenticios en los que incluyen frutos, néctar, insectos, pequeños vertebrados y algunos pueden alimentarse de sangre. Esto le confiere un papel fundamental en el mantenimiento de los ecosistemas y en las sociedades ya que representan formas eficientes de combatir problemas de plagas y enfermedades que afectan las salud de las poblaciones (Chikungunya, entre otras) (Flores-Saldaña, 2008). Una de las funciones especiales de los murciélagos es que ayudan a polinizar diversas especies de plantas, algunas con alto valor para la economía. Otro de las funciones importantes es que actúan regeneradores de bosques al dispersar semillas a grandes distancias contribuyendo de esta forma a la recuperación de hábitats degradados. Estas características los hace un grupo muy interesante para estudios enfocados en la conservación y evaluación del estado de los hábitats, en planes de monitoreo en reservas y empresas privadas que tengan necesidad de diagnosticar el estado de conservación de sus bosques
Este trabajo realizado en la Reservas de Biosfera Indio Maíz del Sureste de Nicaragua. Los muestreos para las capturas de murciélagos se realizaron en distintos tipos de agroecosistemas que se encuentran distribuidos a lo largo de la Cuenca del Río Indio. El objetivo principal del estudio es analizar la estructura y composición de la comunidad de murciélagos en distintos tipos de agroecosistemas para determinar diversidad por cada uno, se correlacionará este dato con la distribución y estado de conservación de las especies que se encuentren dentro del área de estudio. De esta manera, determinar las especies que son claves para el funcionamiento y la estructura de los sistemas ecológicos, que nos proveen alimento para nuestros sustentos y que estas merecen ser conservados en independientemente de sus distribución o hábitat.
MATERIALES Y MÉTODOS
Ubicación de estudio
La Reserva Biológica Indio Maíz está ubicada en el Sureste de Nicaragua, una zona boscosa que cuenta con 2,639.8 Km². Abarca parte de los municipios de San Juan de Nicaragua, Bluefields y El Castillo, y es parte de la Reserva de Biosfera Río San Juan (Fundación del Rio, 2012). El estudio se realizó dentro de esta reserva durante el recorrido del Indian River (Río Indio), en el transepto comprendido en las N 11° 05.919’ W 083° 59.457 (Dans Chavarria, 2014). El área donde se ubica la Reserva Biológica Indio-Maíz se caracteriza por ser la zona más húmeda de Nicaragua, con una precipitación estimada entre los 5,000 y 6,000 mm anuales (Fundación del Rio, 2012). El periodo de lluvias se extiende de mayo a enero y la estación seca varía de tres a cuatro meses, entre febrero y mayo, con un mínimo de lluvias en marzo. Con elevaciones que van desde cero hasta 718 msnm, características geomorfológicas dominada por áreas de origen aluvial conformado por cuatro cuencas hidrográficas: Río Punta Gorda, Río Maíz, Río Indio y Río San Juan (FUNDAR, 2002).
En esta investigación descriptiva la población en estudio comprende todos los murciélagos que se encuentran en los bosques dentro del transecto lineal que abarca 25.8 kilómetros de longitud en el Río Indio basado en la publicación de Flores-Saldaña, 2008.
Muestra y captura
Las muestras equivalen a todos los murciélagos capturados en tres redes de niebla ubicadas en diez puntos de muestreo. En cada punto se hizo una varianza de tres noches de capturas para un total de ocho muestras nocturnas. Cada noche se utilizó 3 redes de niebla (Mist Net) entre las 5:30 pm a 11:00 am, siendo el lapso donde se presenta la mayor actividad de forrajeo de Quirópteros. Estos puntos se encuentran en forma lineal dentro de las áreas boscosas identificadas abarcando aproximadamente 25.8 kilómetros lineales.
Variables de estudio
Las variables analizadas en este estudio fueron el tipo de agroecosistemas, la diversidad biológica por medio del índice de Shannon, la riqueza basado en el índice de Chao, todo ello asociado a las especies identificadas de las cuales se registraron sexo, peso (gr) y longitud del antebrazo (mm) por cada individuo, esto como claves taxonómicas para la identificación (Diaz et al., 2016).
Método de captura de Murciélagos
Se realizaron capturas utilizando redes de niebla de 12 metros de ancho x 2 metros de alto. Se establecieron estaciones de muestreo en cada agroecosistema, manipulando tres redes de niebla en cada punto seleccionado. Las medidas Morfométricas se presentan en milímetros y corresponden a: largo de cuerpo (Lc), cola (C), largo de pata (Lp), largo de oreja (Lo) y longitud de antebrazo (Ab), y el peso (P) se presentará en gramos (R. Medellín et al., 2008; Reid, 2009; Timm et al., 1999) apoyados por la base de datos del Programa para la Conservación de los Murciélagos de Nicaragua (PCMN).
Procedimiento para el análisis de datos
Diversidad Biológica
El índice de Shannon-Wiener es un índice basado en el concepto de equidad también es conocido como índice de la incertidumbre ya que predice a que especie pertenece un individuo escogido al azar de una aglomeración, y se basa en el supuesto de que los individuos se escogen al azar y que las especies están representadas en la muestra. Este índice adquiere valores entre cero y uno cuando solamente se encuentra una especie (Krebs, 1985; Moreno, 2001).
Donde:
H′: Diversidad de Shannon. S: Número total de especies en la comunidad y pi: Proporción de S formado por las especies
La equitatividad en la comunidad se obtuvo a partir del índice de la Equidad de Pielou (J′), que es el resultado del cociente de la diversidad observada (H′) y la máxima diversidad expresada (H′ max), donde H′ max =ln (S).
Donde:
H′: Diversidad de Shannon y H′ max: Máxima diversidad expresada =ln (S)
Similitud entre comunidades
El índice propuesto por Chao, Chazdon, Colwell, & Shen (2005)está basado en los modelos Clásicos de similitud/disimilitud de Jaccard y Sorensen. Este nuevo índice le agrega el enfoque de la riqueza de las especies, la abundancia relativa y adopta una estrategia no paramétrica incorporando el efecto de las especies compartidas no vistas, por lo tanto, el índice nuevo de Jaccard con base a la abundancia es:
Donde:
U y V equivalen a las abundancias totales de las especies compartidas en los ensamblajes, y los índices tienden a 1 cuando las similitudes de pasaje idénticos y tienden a 0 cuando los ensamblajes son diferentes o disimilares.
Análisis estadístico
Se realizaron comparaciones de los tipos de agroecosistemas presentes en la zona de estudio. La significancia estadística para dichos índices, se evaluó mediante la prueba no paramétrica de Kruskal-Wallis (Sokal & Rohlf, 1981). Con la prueba de Análisis de la Varianza (ANOVA), para los cual se analizarán los supuestos de normalidad y homogeneidad de varianza desde el programa SPSS versión 25 (IBM® Statistical SPSS®, 2016), a posteriori se realizó comparaciones de Fisher que permitieron observar cuales grupos presentan diferencias significativas entre ellos.
RESULTADOS Y DISCUSIÓN
Tabla 1. Inventario taxonómico de las comunidades de murciélagos en distintos tipos de agroecosistemas en Reserva Biológica Indio Maíz
| Hábitat | Familia | Subfamilia | Especies | Recuento |
| Bosque Húmedo | Emballonuridae | Rhynchonycteris naso | 1 | |
| Saccopteryx leptura | 2 | |||
| Furipteridae | Furipterus horren | 2 | ||
| Phyllostomidae | Carollinae | Carollia sowelli | 20 | |
| Carollia castanea | 54 | |||
| Desmodontinae | Desmodus rotundus | 1 | ||
| Glossophaginae | Glossophaga commissarisi | 28 | ||
| Glossophaga soricina | 2 | |||
| Hylonycteris underwoodi | 2 | |||
| Phyllostomidae | Phyllostominae | Lophostoma silvicolum | 5 | |
| Trachops cirrhosus | 2 | |||
| Chrotopterus auritus | 1 | |||
| Stenodermatinae | Artibeus jamaicensis | 44 | ||
| Dermanura phaeotis | 9 | |||
| Dermanura watsoni | 22 | |||
| Artibeus lituratus | 16 | |||
| Stenodermatinae | Platyrrhinus helleri | 1 | ||
| Uroderma convexum | 3 | |||
| Chiroderma villosum | 4 | |||
| Vespertilionidae | Myotis nigricans | 3 | ||
| Myotis riparius | 6 | |||
| Bosque Húmedo (borde) | Emballonuridae | Saccopteryx billineata | 8 | |
| Saccopteryx leptura | 2 | |||
| Phyllostomidae | Carollinae | Carollia castanea | 4 | |
| Carollia sowelli | 5 | |||
| Desmodontinae | Desmodus rotundus | 1 | ||
| Glossophaginae | Glossophaga commissarisi | 4 | ||
| Hylonycteris underwoodi | 1 | |||
| Stenodermatinae | Artibeus jamaicensis | 6 | ||
| Dermanura phaeotis | 2 | |||
| Dermanura watsoni | 1 | |||
| Ectophylla alba | 1 | |||
| Artibeus lituratus | 2 | |||
| Vespertillionidae | Myotis riparius | 1 | ||
| Rhogeessa io | 1 | |||
| Bosques Riparios Rio San Juan | Emballonuridae | Cyttarops alecto | 1 | |
| Rhynchonycteris naso | 3 | |||
| Cormura brevirostris | 1 | |||
| Noctilio albiventris | 1 | |||
| Noctilionidae | Noctilio leporinus | 1 | ||
| Phyllostomidae | Carollinae | Carollia castanea | 6 | |
| Carollinae | Carollia sowelli | 3 | ||
| Desmodontinae | Desmodus rotundus | 2 | ||
| Glossophaginae | Glossophaga commissarisi | 9 | ||
| Glossophaginae | Glossophaga soricina | 1 | ||
| Glossophaginae | Lonchophylla robusta | 1 | ||
| Phyllostominae | Macrophyllum macrophyllum | 1 | ||
| Stenodermatinae | Artibeus jamaicensis | 2 | ||
| Stenodermatinae | Dermanura watsoni | 4 | ||
| Stenodermatinae | Artibeus lituratus | 3 | ||
| Stenodermatinae | Sturnira parvidens | 1 | ||
| Thyropteridae | Thyroptera tricolor? | 2 | ||
| Vespertillionidae | Myotis riparius | 3 | ||
| Bosque riparios Boca Rio Bartola | Noctilionidae | Noctilio albiventris | 2 | |
| Noctilio leporinus | 1 | |||
| Emballonuridae | Rhynchonycteris naso | 1 | ||
| Bosque Cerrado - CeTAF | Phyllostomidae | Glossophaginae | Glossophaga commissarisi | 1 |
| Phyllostominae | Lophostoma brasiliense | 1 | ||
| Stenodermatinae | Dermanura watsoni | 2 | ||
| Artibeus lituratus | 1 | |||
| Sturnira parvidens | 1 | |||
| Mimon crenulatum | 1 | |||
| Frutales - CeTAF | Molossidae | Molossus molossus | 1 | |
| Phyllostomidae | Carollinae | Carollia perspicillata | 3 | |
| Glossophaginae | Glossophaga soricina | 2 | ||
| Phyllostominae | Mimon crenulatum | 2 | ||
| Stenodermatinae | Artibeus jamaicensis | 2 | ||
| Dermanura watsoni | 14 | |||
| Artibeus lituratus | 8 | |||
| Platyrrhinus helleri | 2 | |||
| Phyllostomidae | Stenodermatinae | Vampyriscus nymphaea | 1 | |
| Transición Frutales - Bosque (CeTAF) | Phyllostomidae | Stenodermatinae | Dermanura watsoni | 1 |
| Artibeus lituratus | 1 | |||
| Bosque post huracanado Guinea | Emballonuridae | Saccopteryx billineata | 1 | |
| Phyllostomidae | Glossophaginae | Glossophaga soricina | 2 | |
| Carollinae | Carollia castanea | 1 | ||
| Vespertilionidae | Myotis nigricans | 1 | ||
| Myotis riparius | 3 | |||
| Canta Gallo | Emballonuridae | Saccopteryx billineata | 1 | |
| Vespertilionidae | Myotis riparius | 4 | ||
| Phyllostomidae | Stenodermatinae | Artibeus lituratus | 5 | |
| Glossophaginae | Glossophaga soricina | 2 | ||
| Silla | Mormoopidae | *Pteronotus rubiginosus | 1 | |
| Phyllostomidae | Stenodermatinae | Artibeus jamaicensis | 1 | |
| Emballonuridae | Peropterix kappleri | 1 | ||
| Rhynchonycteris naso | 1 | |||
| * Corresponde a Pteronotus parnellii | ||||
Se capturo un total de 384 individuos y 39 especies, distribuidas en 8 familias y (Medina-Fitoria, 2014). Del total de individuos registrados predominan las hembras con 228 (59.4%) especímenes, de las cuales, 47 individuos presentan condiciones reproductivas de lactantes, en el caso de machos se examinaron 156 (40.6%) y se identificaron 58 (37%) individuos con la condición de escrotados. El 71% del total de individuos se encuentran en buen estado de salud y no presentan ectoparásitos. El total de quirópteros encontrados en el estudio equivale al 35% (39 especies) del total de especies (111) representados para nuestro país (Medina et al., 2019; Saldaña et al 2020). La familia Phyllostomidae fue la más representativo. De esta misma familia que comprende 5 subfamilias, los Stenodermatinae presentaron mayor riqueza de especies. Los Stenodermatinae son abundantes y se consideran importantes dispersores de semillas en los bosques tropicales, particularmente de especies encontrados en crecimiento secundario temprano o sucesionales y en claros de bosques.
Esto podría dar respuesta a esta tendencia que por lo general en Indio Maíz los bosques están en un proceso de sucesión continúo existiendo claros en toda la reserva dominado por especies de palmáceas y heliconias marantáceas en donde muchas de ellos son utilizadas por especies constructoras de tiendas y fuentes de alimento. Además, según criterios de conservación de la lista roja actualizada por Medina-Fitoria (2018) sobresale Furipterus horrens de la familia Furipteridae por estar catalogada como una especie en peligro de extinción en Nicaragua y distribuida desde el sureste de Nicaragua hasta Perú y el este de Brasil. Por otra parte, a Ectophylla alba con presencia solo en la franja caribeña de Nicaragua y Rhogeessa io restringido solo al sureste de nuestro país,que están dentro de la lista de especies amenazadas.
La mayoría de las especies pocos comunes pertenecen a la familia de los Phyllostomidae. Especies como Ectophylla alba, Thyroptera tricolor (Thyropteridae)prefieren bosques húmedos y sin una alta intervención. Otras Especies como Lophostoma silviculum, Macrophyllum, Trachops cirrhosus son especies bioindicadores de calidad de hábitat ya que muchos de ellos fueron encontrados en hábitat con nivel de intervención bajo y son propias de bosque maduro (Medina-Fitoria, 2014), estas especies son indicadores de la integridad del ecosistema. De tal manera, también, hubo especies que sobresalieron en casi todos los hábitats, en el cuadro 1 se describen estas especies que fueron mucho más comunes y fueron capturados en distintos tipos de condiciones (Flores-Saldaña, 2008). En estas especies se tienen a Artibeus jamaicensis, Artibeus lituratus, Glossophaga soricina que por lo general no aparecen. Carollia castanea y Carollia sowelli que también se presentaron en muchos de los hábitats muestreados, son también especies generalistas que tienen amplia distribución en el país y aprovechan distintos tipos de hábitat. Además, son importantes en la regeneración de los bosques ya que son murciélagos que se especializan y explotan el máximo las fuentes de alimentos que encuentran, en la obtención de frutas y flores (néctar y polen) para sus hábitos alimenticios y ayudan a la dispersión de semillas de muchas plantas (R. A. Medellín et al., 2000).
En la figura 1, el 44% de las especies registradas en los agroecosistemas son insectívoros que por lo general dominan la distribución con más del 40%, seguidamente, los frugívoros con el 35%. Esta diferencia puede deberse a la interacción de factores climáticos (lluvia), ciclo lunar (luna llena), competencia (especies adaptables y aprovechables), productividad (fuente de alimento), heterogeneidad espacial (características de los hábitats) y métodos de muestreo (redes de niebla). Cabe destacar que esta tendencia de insectívoros posiblemente se incrementó con la dominancia numérica de especies como Myotis riparius y Myotis nigricans que fueron altamente representativos en algunos agroecosistemas.
El bosque húmedo borde intervenido, dada la diversidad de murciélagos, y la estructura funcional pueden calificarse como una unidad también muy importante para estos mamíferos. Las dos unidades anteriores (Bosques Riparios Río San Juan está altamente Intervenido, no obstante se identificaron 18 spp y 45 individuos) los que tienen, aparentemente una adecuada oferta de hábitat y de recursos que permiten el sostenimiento de una comunidad de murciélagos diversa y en equilibrio (Chambers, et al., 2016).
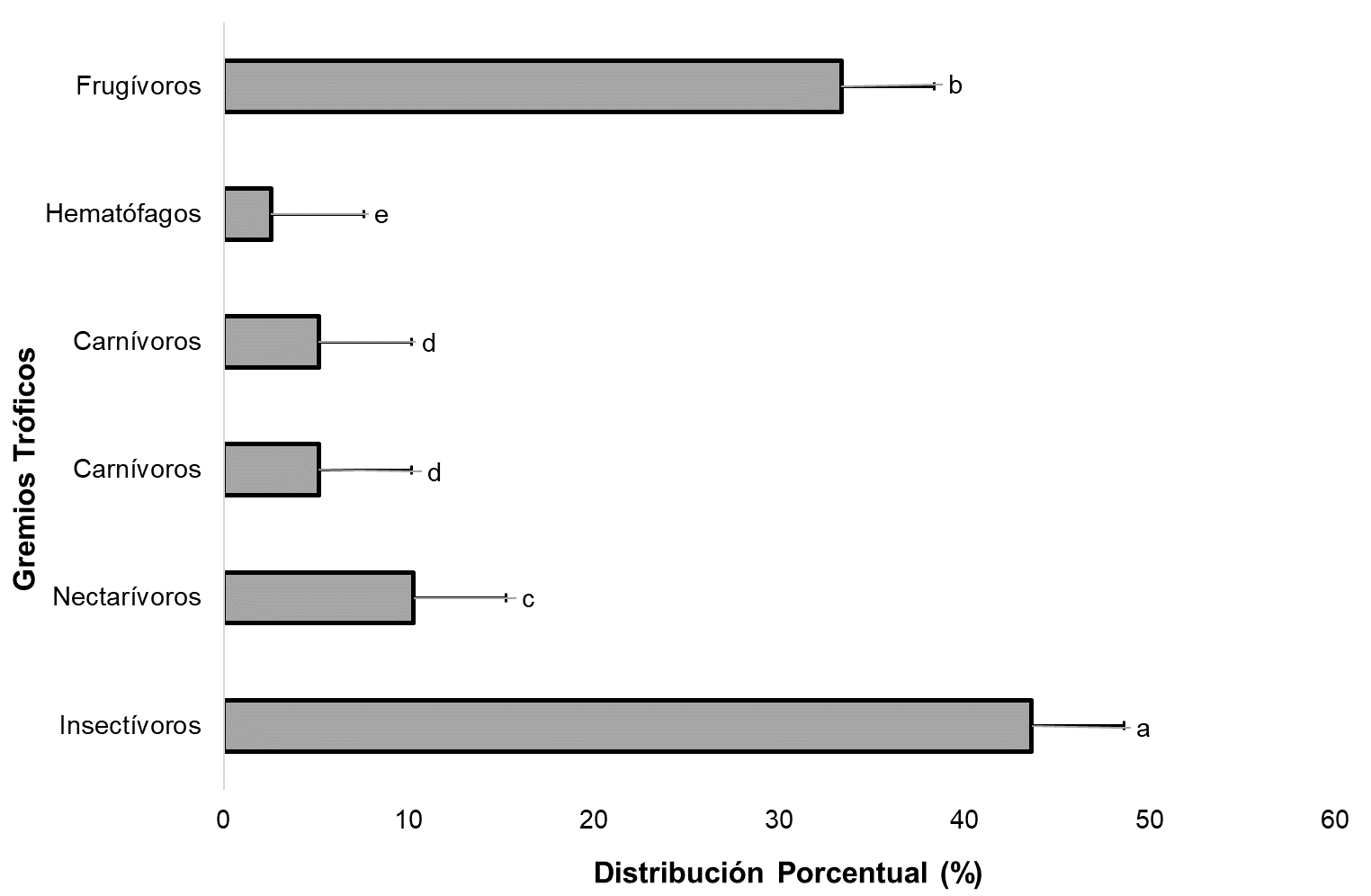
Figura 1. Distribución de los Gremios Tróficos de las especies identificadas en las comunidades de murciélagos en distintos tipos de agroecosistemas en la Reserva Biológica Indio Maíz. Prueba estadística Análisis de Varianza (ANOVA) - Diferencia Mínima Significativa (DMS = 0.95). Letras (a-e) distintas indican diferencia estadística α=0.05. En la gráfica se han empleado los valores de la Media (Md) y Desviación Estándar (DE).
Tabla 2. Gremios funcionales de las especies identificadas en las comunidades de murciélagos en distintos agroecosistemas en la Reserva Biológica Indio Maíz
| Uso de hábitat | Especie | Gremio Trófico |
| Especialista de bosque (EB) | Vampyriscus nymphaea | Frugívoro |
| Ectophylla alba | Frugívoro | |
| Furipterus horrens | Insectívoro | |
| Thyroptera tricolor | Insectívoro | |
| Macrophyllum macrophyllum | Insectívoro | |
| Lophostoma brasiliense | Insectívoro | |
| Lophostoma silvicolum | Insectívoro | |
| Mimon crenulatum | Insectívoro | |
| Trachops cirrhosus | Carnívoro | |
| Chrotopterus auritus | Carnívoro | |
| Generalista de Bosque (GB) | Noctilio albiventris | Carnívoro e Insectívoro |
| Noctilio leporinus | Carnívoro e Insectívoro | |
| *Preonotus rubiginosus | Insectívoro | |
| Hylonycteris underwoodi | Nectarívoro | |
| Lonchophylla robusta | Nectarívoro | |
| Carollia castanea | Frugívoro | |
| Carollia sowelli | Frugívoro | |
| Dermanura phaeotis | Frugívoro | |
| Dermanura watsoni | Frugívoro | |
| Uroderma convexum | Frugívoro | |
| Platyrrhinus helleri | Frugívoro | |
| Chiroderma villosum | Frugívoro | |
| Myotis riparius | Insectívoro | |
| Rhogeessa io | Insectívoro | |
| Molossus molossus | Insectívoro | |
| Generalista (GE) | Rhynchonycteris naso | Insectívoro |
| Saccopteryx bilineata | Insectívoro | |
| Saccopteryx leptura | Insectívoro | |
| Peropteryx kappleri | Insectívoro | |
| Cormura brevirostris | Insectívoro | |
| Cyttarops alecto | Insectívoro | |
| Glossophaga comissarisi | Nectarívoro | |
| Glossophaga soricina | Nectarívoro | |
| Carollia perspicillata | Frugívoro | |
| Sturnira parvidens | Frugívoro | |
| Artibeus jamaicensis | Frugívoro | |
| Artibeus lituratus | Frugívoro | |
| Desmodus rotundus | Hematófago | |
| Myotis nigricans | Insectívoro |
De la totalidad de especies de murciélagos del mundo, solamente hay tres que se alimentan de sangre, y de esas sólo una se alimenta de sangre de mamífero, que es el vampiro común (Rodríguez-Herrera & Sánchez, 2015). El 70% de ellos se alimenta de insectos, como polillas, moscas, mosquitos y escarabajos (pueden llegar a comer la mitad de su peso en una sola noche) y, el resto se alimenta de polen y frutos, o son carnívoros y pueden comer ranas, lagartijas, ratones y a veces a otros ejemplares de su especie. La presencia de especies de murciélagos taxonómicamente diversa es esencial para determinar la calidad de un ambiente o un ecosistema. El comportamiento inusual de una especie que tiene preferencias por un tipo de hábitat, puede indicar cambios en los sistemas ecológicos (WHittaker, 1970). Las especies que fueron identificados como especialistas de bosques, tienden a presentarse menos en áreas con niveles de disturbios. En este caso estas se comportan como especies de tipo I, aquellos que indican la integridad o el estado del hábitat. El 40% de las especies en este grupo de Especialistas de bosques fueron capturados en el Bosque húmedo, destacando: Trachops cirrhosus y Chrotopterus auritus en el tope de la cadena trófica como predadores, ambos carnívoros. Sus presencias en este tipo de bosque deben ser por el requerimiento de extensas áreas que ofrece este agroecosistema para forrajear con grandes rangos de movimiento (Espinoza et al., 2004).
Entre las especies especialistas de bosques identificadas, destacan los Phyllostominae-insectívoros: Lophostoma brasiliense, Lophostoma silvicolum, Mimon crenulatum, los que son muy sensibles a altos niveles de perturbación. También se identificaron dos especies, Furipterus horrens (Furipteridae), Thyroptera tricolor (Thyropteridae) que son endémicas en América y Ppropios de Centroamérica y Suramérica. F. horrens es típico del interior del bosque, conocido únicamente en el Sureste de Nicaragua (Medina-Fitoria, 2014). Esta especie insectívora, se capturó únicamente dentro del Bosque Húmedo (BH), aparentemente la especie se encuentra asociada a sistemas ambientales saludables y equilibrados que le proveen los requerimientos alimenticios como son insectos pequeños (moscas, zancudos y polillas) forrajeando lentamente de uno a cinco metros del suelo, sugiriendo el vuelo de las mariposas Morpho. (Roughgarden, J., & Diamond, J. 1986).
En el caso de Thyroptera tricolor (Thyropteridae), también tiene su distribución al sureste de Nicaragua prefiriendo bosques húmedos lluviosos. Parece que el Bosque ripario Rio San Juan le permite a esta especie hacer sus interacciones ecológicas ya que son muy versátiles (volubles). Probablemente esto se debió a la presencia de plantas de Heliconia que fueron muy comunes a lo largo de la ribera del río. Otras especies insectívoras (Phyllostominae) de follaje como Macrophyllum macrophyllum considerado como el único miembro de la subfamilia Phyllostominae completamente insectívora. Las dos formas de forrajeo (pescar insectos en la superficie de agua y captura aérea) le confieren un buen indicador de hábitat ya que esta se aprovecha de espacios claros sobre el agua, hábitat en donde ningún Phyllostomidae ha dominado (Medina-Fitoria, 2014). También, especies frugívoros (Ectophylla alba,) fue capturado dentro de bosques bien conservados, por otro lado, Vampyricus nymphaea encontrado en Frutales CeTAF (Centro de Transferencia Agroforestal de BICU) parece estar alimentándose en este sitio, perchando o durmiendo en la parte de Bosque Cerrado.
En áreas con bajos niveles de deforestación, los murciélagos frugívoros suelen cruzar las áreas abiertas o perturbadas en búsqueda de alimento y refugio en los fragmentos de bosque (MARENA, 2007). Sin embargo, con el incremento de las áreas deforestadas o fragmentadas, la conectividad de los parches de bosque remanentes disminuye y probablemente pocas especies de frugívoros podrían ser capaces de cruzar las grandes áreas sin cobertura de bosque (Estrada-Villegas et al., 2010). Por ejemplo, algunos estudios sugieren que la fragmentación influye negativamente en la abundancia de Artibeus obscurus (Faria, 2006), aunque otros estudios sugieren que esta especie parece ser menos sensible a la fragmentación que otras especies de Artibeus grandes (Henry et al., 2007) o simplemente no es afectada (De Serres et al., 2009). En el caso de este estudio más del 85% de las especies son frugívoros e insectívoros, en ambos casos, dependen directamente de la estabilidad de las masas forestales y la diversidad de individuos, tanto animales (insectos) como plantas ya sea para alimentarse de los frutos o del néctar de sus flores que a su vez dependen de la polinización que realizan para la fecundación de individuos a distancias considerables (Casallas et al., 2017). Se reporta una especie hematófaga (Desmodus rotundus) que contrario a la creencia popular no es perjudicial al hombre siempre y cuando el ecosistema mantenga la estabilidad adecuada, lo que evitará los ataques de hematófagos al ganado u otras especies domésticas (Ferro Muñoz et al., 2018).
En la figura 2 se presentan los resultados para los análisis de índices de diversidad Biológica de murciélagos por los distintos agroecosistemas. El bosque húmedo representa mayor índice de diversidad diferenciando así de los otros (P-valor>0.000). El bosque húmedo (borde), frutales CeTAF y bosque Ripario Río San Juan se encontraron de menor índices diversidad como el bosque Ripario rio Bartola, transición frutales bosque CeTAF, bosque post huracanado. En el bosque húmedo y bosque húmedo (borde) se encuentran con mayor índice de biodiversidad dado a que estos hábitat no hubo un impacto significativo por el huracán Mitch (Galindo Gonzales, 1998). Además, en estos dos hábitats no existe alta intervención y presenta las condiciones de cualquier tipo de especies de animales a diferencia de los otros sitios también la cobertura de bosque sin intervención es alta. Esto genera la hipótesis de biodiversidad, que a medida se incrementa la cobertura de bosques (espacio y alimento) y se disminuye los fragmentos, se incrementa la riqueza es por estas condiciones que la mayor parte de las especies se encuentran en estos hábitats. El bosque húmedo es un tipo de hábitats que alberga gran riqueza de especies de plantas que son importantes en la dieta alimenticia de las especies (Delavaux, 2013). Debe destacarse que las especies Ectophylla alba y Rhogeessa io de acuerdo a la Lista Roja de Nicaragua se encuentran en estatus de Amenazados (A) con poblaciones decrecientes, en tanto Furipterus horrens y Thyroptera discifera están en Peligro de Extinción (PE) con poblaciones reducidas.
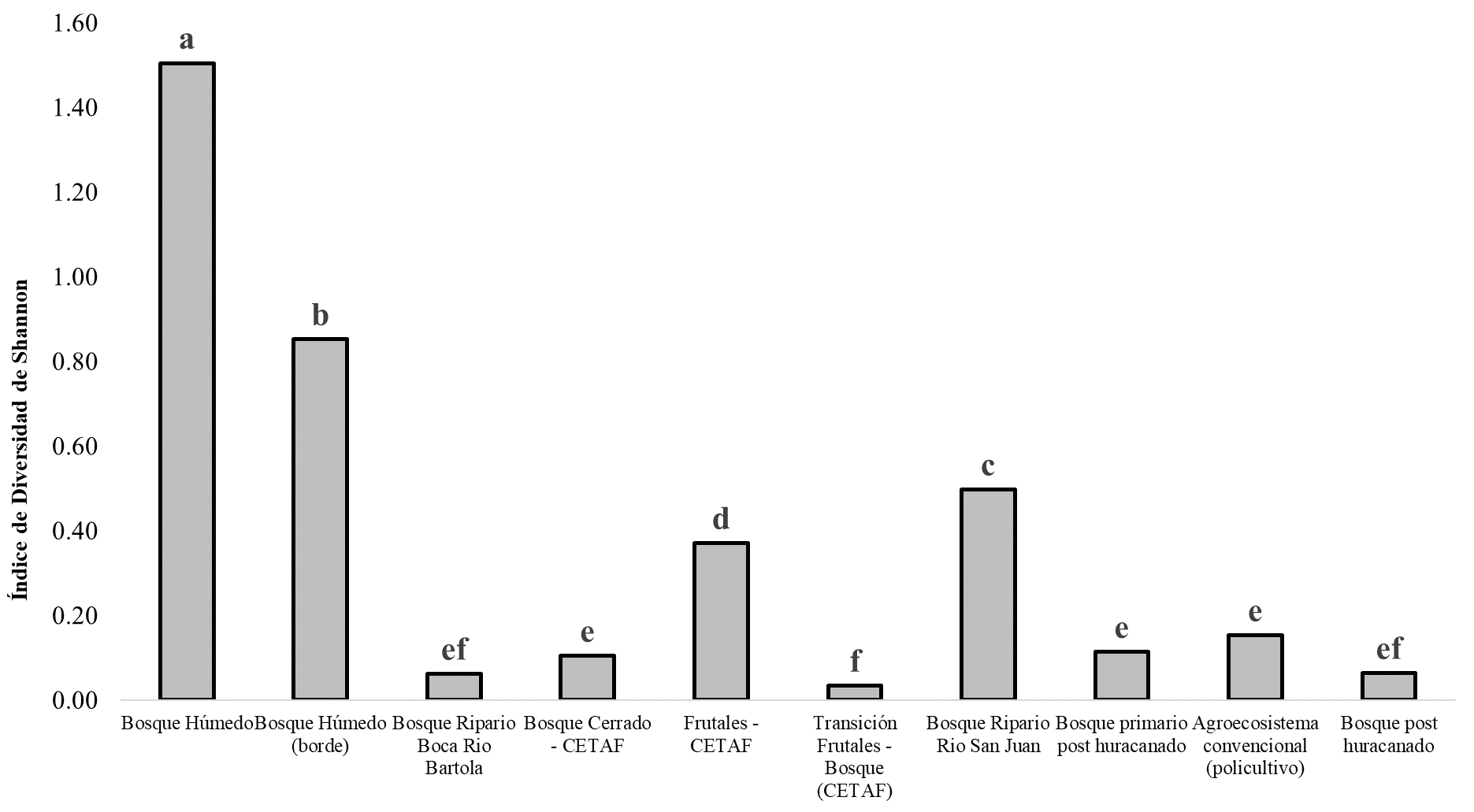
Figura 2. Índices de diversidad biológica de las comunidades de murciélagos en diferentes tipos de agroecosistemas en la Reserva Biológica Indio Maíz. Prueba estadística Análisis de Varianza (ANOVA) - Diferencia Mínima Significativa (DMS = 0.95). Letras (a-f) distintas indican diferencia estadística α=0.05. En la gráfica se han empleado los valores de la Media (Md) y Desviación Estándar (DE).
Las especies representadas en la muestra se ubican en las familias Mormoopidae, Thyropteridae, Noctilionidae, Furipteridae, Vespertilionidae, Emballonuridae, Molossidae y Phyllostomidae. Esta última incluye a su vez cinco subfamilias (Carollinae, Stenodermatinae, Phyllostominae, Glossophaginae y Desmodontinae). Los Phyllostomidae representan patrones de abundancia muy alta, seguidamente de los Vespertiliodos y con menores proporción se encuentran las familias Mormoopidae, Furipteridae, Molossidae). Dentro de la subfamilia Carollinae de la familia Phyllostomidae, la especie Carollia castanea fue la más abundante en el total de especies capturados con 17.5% del total de todos los muestreos. Cabe mencionar que esta especie no fue capturado en todos los sitios de muestreos, sin embargo, es una especie con distribución amplia de toda la región de Nicaragua (Chambers et al., 2016; Medina-Fitoria, 2014; Siu et al., 2018).
El bosque primario post huracanado (Guinea), bosque post huracanado (Silla) son algunos de los bosques con menor diversidad de capturas debido a las condiciones ambientales (lluvia) que se presentaban en los diferentes lugares al igual que la estructura del bosque que fue modificada por el pase el huracán Otto. El bosque se caracterizaba por presentar una composición de matorrales densos homogéneamente en todas las estaciones muestreo dentro de este sitio de dos metros de altura no pudiendo establecer las redes en los diferentes puntos deseadas. Sin embargo, en el agroecosistema convencional (policultivo), se ha observado una diferencia mínima de diversidad aparte de los otros espacios, dado que en este tipo de hábitat proporciona una amplia diversidad de alimentos como frutas, árboles maderables, frijoles, maíz, calabazas, cacao, entre otras. Por otra parte podemos ver como el hábitat frutales y el bosque Ripario Rio San Juan tienen una diferencia significativa (Cleveland et al., 2006; Fenton et al., 1992; Montero & Espinoza, 1999; Zolotoff-Pallais & Medina-Fitoria, 2005). Este último fue debido a que estos hábitats, son diferentes en la posición geográfica. El bosque Ripario presento una diversidad alta por la cercanía del cuerpo de agua en este muestreo donde existe una amplia gama de alimento. Destacamos también que en este sitio se capturo las dos especies pescadores (Noctilionidae) que existe en Nicaragua.
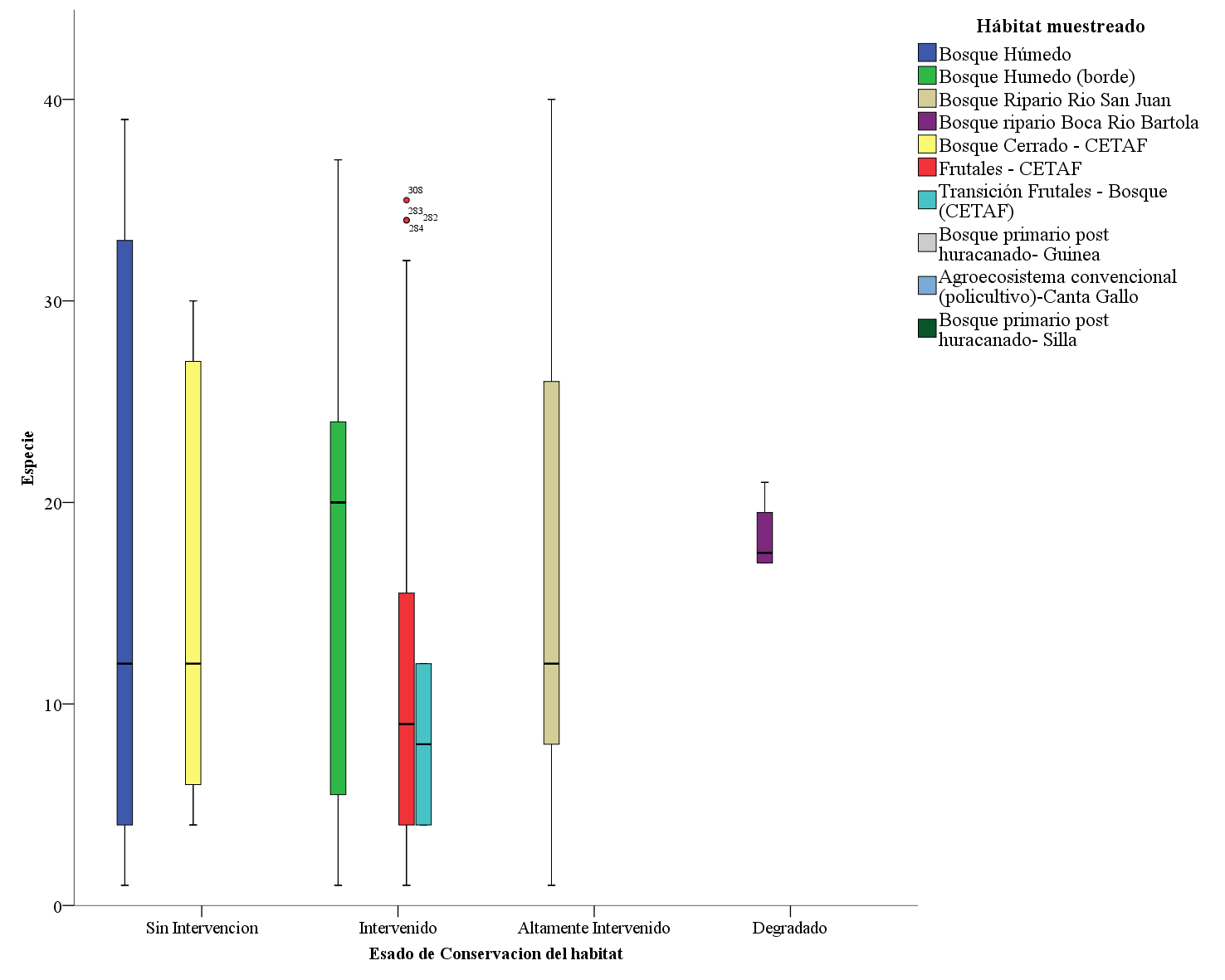
Figura 3. Distribución de las especies de murciélagos como bioindicadores ambientales en la sostenibilidad en los ecosistemas de la Reserva Biológica Indio Maíz.
La distribución de las especies aparece proporcionalmente de acuerdo con la conservación de los hábitats más complejo a lo menos complejo. El bosque húmedo sin intervención alberga la mayor cantidad de especies e individuos. Este tipo de hábitat con características complejas en la estructura de los ecosistemas brinda mayores servicios ecosistémicos para la subsistencia de la fauna silvestre y de las comunidades de los murciélagos del Caribe de Nicaragua. Mientras tanto, la figura 3 muestra como la mayor cantidad de especies fueron muestreados en los habitas de mayor estado de conservación y en reducción significativa en los bosques intervenidos. Por tal razón los bosques intervenidos tienen una cercana relación con el bosque sin intervención debido a que muchas de las especies establecidas en los habitas de mayor degradación se movilizan a los más conservados en búsqueda de alimento y refugio (Galindo Gonzales, 2004).
El bosque Ripario de Río San Juan, caracterizado por una alta intervención por la acción antrópica (casas y cultivos) y natural (huracán Otto), presenta riqueza de especies con valores por debajo del bosque de los dos primeros hábitats. Este resultado es llamativo porque comparando con los hábitats de Silla y Guinea estos son muy diferenciados. Por lo que se supone que este resultado fue porque el bosque Ripario de rio San Juan estuvo altamente intervenido, los muestreo hechos aquí no tuvieron factores de lluvia y luna (el efecto conocido como fobia lunar por parte de los murciélagos) que pudieron disminuir las capturas (Flores-Saldaña, 2008; Montero & Espinoza, 1999).
De acuerdo con la distribución de las especies por Hábitat, las especie que aparecen con valores únicos, es decir, son especies menos comunes durante los muestreos en los Hábitat se refieren a las especies que se mencionaran: El bosque húmedo con especies de apariciones únicas entre ellas las especies Furipterus horren, Lophostoma silviculum, Trachops cirrhosus, Chrotopterus auritus, Uroderma conexum y Chiroderma villosum. el bosque húmedo borde presenta a Ectophylla alba y Rhogeessa io. Mientras tanto, el bosque ripario Río San Juan presenta a Cyttarops alecto, Lonchophylla robusta, Macrophyllum macrophyllum y Thyroptera tricolor. El bosque cerrado a Lophostoma brasiliense. El bosque frutal de CeTAF con Carollia perspicillata y Vampyriscus nymphaea. Por último, el Hábitat de bosque post huracanado Silla con Pteronotus rubiginosus y Peropterix kappleri.
La mayoría de estas especies pocos comunes pertenecen a la familia de los Phyllostomidae. Especies como Ectophylla alba, Thyroptera tricolor (Thyropteridae)prefieren habitar en bosques húmedos y sin una alta intervención. Otras Especies como Lophostoma silviculum, Macrophyllum macrophyllum, Trachops cirrhossus son especies bioindicadores de calidad de hábitat ya que muchos de ellos son propias de bosque maduro e indicadores de perturbación de hábitat o ecosistema altamente intervenido (Medina-Fitoria, 2014). De tal manera, también, hubo especies que sobresalieron en la mayoría de los hábitats, en este cuadro se observa cuáles son estas especies que fueron mucho más comunes y fueron capturados en distintos tipos de condiciones del hábitat. La adaptabilidad de los murciélagos es clasificada de acuerdo con su respuesta a la fragmentación del paisaje (Galindo-González et al., 2000). En la familia Phyllostomidae se incluyen subfamilias de alta sensibilidad a las modificaciones del paisaje (hábitats) en el que habitan, por lo cual son considerados como bioindicadores de estabilidad del ecosistema (Galindo-González, 2004). En base a estas características se han establecido tres niveles de adaptabilidad para las especies de murciélagos. Ellos son:
Tipo I, las especies son dependientes del hábitat, muy sensibles a las perturbaciones, intolerantes a los espacios abiertos.
Tipo II, las especies vulnerables, toleran cierto grado de perturbaciones, llegan a utilizar fragmentos y vegetación ripiara.
Tipo III, Especies adaptables, toleran fuertes transformaciones del hábitat, llegan a utilizar espacios abiertos como pastizales con árboles y arbustos aislados, algunas especies se benefician con estas transformaciones del ambiente.
Basado en los datos contenidos en este estudio más del 60% de las especies de murciélagos muestreados en este estudio pertenecen a los Tipos I y II de adaptabilidad, razón por la cual se debe hacer especial énfasis en la conservación de estos agroecosistemas ya que las perturbaciones, por más mínimas que sean, significarían la perdida de estas especies que a su vez son indispensables para estabilidad ambiental y ecológica de los hábitats en los cuales habitan generando una relación mutuamente benéfica, pero a la vez dependiente.
En la tabla 3 para comparar los diferentes tipos de ecosistemas se calculó índices de similitud relacionando el hábitat por la presencia y la ausencia de especie (MacSwiney G, 2010; Moreno, 2001). Los hábitats más parecidos entre ellos son el Bosque primario post huracanado-Silla y el bosque ripario Boca Rio Bartola (borde) con índice de similitud de 094. De esta manera también el hábitat del bosque de transición frutales y frutales CETAF con índices de similitud de (0.94). Posteriormente el bosque húmedo y el bosque húmedo borde también son parecidos entre ellos (0.98). Es prescindible mencionar que estos datos no reflejan resultados tan absolutos, dado que en el Hábitat de transición frutales en el CeTAF el resultado debió ser por una mínima parte de esfuerzo de captura (un día) por lo que con mayor esfuerzo de captura este resultado podría tener diferencias significativas (Siu et al., 2018).
De todo lo anterior al comparar la similitud entre los hábitats el análisis muestra que existe una gran diferencia de similitud entre el Bosque húmedo, Bosque húmedo (borde) y los otros hábitats. Es destacable el hecho que el bosque húmedo es uno de los ecosistemas neotropicales que es estable en la conservación de especies silvestres ya que en ella existe incomparables condiciones de vida para todo tipo de animales y sus estrategias de sobrevivencias muchas veces han evolucionado en función de este ecosistema (Ferro Muñoz et al., 2018; Flores-Saldaña, 2008; Sosa et al., 2008). Entre ellas los murciélagos que utilizan frecuentemente los recursos que proporciona están los frugívoros, insectívoros, nectarívoros y en menor medida los hematófagos (Ferro Muñoz et al., 2018; Flores-Saldaña, 2008). Por otro lado, existe una diferencia significativa comparando los tres hábitats en Indio Maíz con los otros hábitats con menores porcentajes de similitud.
Tabla 3. Índice de similitud de las comunidades de murciélagos en diferentes de agroecosistemas en la: Reserva Biológica Indio Maíz
| Hábitat muestreado | Bosque Húmedo | Bosque primario post huracanado- Silla | Bosque Húmedo (borde) | Bosque Ripario Rio San Juan | Bosque Ripario Boca Rio Bartola | Bosque Cerrado - CeTAF | Frutales CeTAF | Transición Frutales - Bosque (CeTAF) | Bosque primario post huracanado- Guinea | Agroecosistema convencional (policultivo)-Canta Gallo |
| Bosque Húmedo | - - - | 0.06 | 0.89 | 0.56 | 0.06 | 0.08 | 0.47 | 0.07 | 0.06 | 0.07 |
| Bosque primario post huracanado- Silla | - - - | 0.12 | 0.15 | 0.94 | 0.09 | 0.03 | 0.93 | 0.03 | 0.93 | |
| Bosque Húmedo (borde) | - - - | 0.38 | 0.05 | 0.06 | 0.15 | 0.03 | 0.06 | 0.06 | ||
| Bosque Ripario Rio San Juan | - - - | 0.43 | 0.06 | 0.32 | 0.05 | 0.42 | 0.45 | |||
| Bosque Ripario Boca Rio Bartola | - - - | 0.91 | 0.06 | 0.94 | 0.66 | 0.52 | ||||
| Bosque Cerrado - CETAF | - - - | 0.92 | 0.91 | 0.08 | 0.90 | |||||
| Frutales - CETAF | - - - | 0.47 | 0.12 | 0.70 | ||||||
| Transición Frutales - Bosque (CETAF) | - - - | 0.05 | 0.87 | |||||||
| Bosque primario post huracanado- Guinea | - - - | 0.67 | ||||||||
| Agroecosistema convencional (policultivo)-Canta Gallo | - - - |
CONCLUSIONES
El total de especies encontradas en todos los muestreos representan el 17% del total de especies de fauna registrado en nuestro país. De estos datos antes mencionados, el 35% equivale al total de especies de quirópteros en Nicaragua y el 9% (10 especies) tiene su distribución restringida en el caribe de Nicaragua. La familia Phyllostomidae fue más dominante en el estudio. Con predominio de la especie Carollia castanea (Carollinae), sin embargo, la subfamilia Stenodermatinae fue más representativa en cuanto a la diversidad de especies. Las familias que menos sobresalieron fueron: Mormoopidae, Molossidae y Furipteridae. Además, en este estudio sobresalió la especie Rhogeessa io por estar catalogada como especie amenazada de extinción en Nicaragua. La distribución de especies está relacionada a la complejidad según el estado de conservación de los hábitats. Determinamos que hubo una alta diversidad de especies en los bosques sin intervención y una baja diversidad en los degradados. La subfamilia Phyllostominae fue más representativa en cuanto a especies con presencias únicas en todos los muestreos o hábitat. La familia Phyllostomidae aparece de nuevo con la más representatividad en cuanto a especies que se distribuyen de manera equitativa en casi todos los muestreos y los Stenodermatinae con más representativo en el bosque húmedo. De esta manera los Phylostomidos presentan alta diversidad en bosques pocos intervenidos por acciones humanas y naturales.
Los datos recolectados en esta investigación pasan a formar parte de la base de datos nacional gestionada por el Programa de Conservación de Murciélagos de Nicaragua y las Redes Iberoamericana y Latinoamericana para la conservación de Murciélagos colocando a BICU como una de las universidades punteras en estudios de comunidades de quirópteros en relación con sus hábitats en Nicaragua.
REFERENCIAS
Casallas, D., Calvo, N., & Rojas, R. (2017). Murciélagos dispersores de semillas en gradientes sucesionales de la orinoquia (san martín , meta Colombia). Acta biológica colombiana, 22(3), 348–358. https://doi.org/10.15446/abc.v22n3.63561
Chambers, C. L., Cushman, S. A., Medina-Fitoria, A., Martínez-Fonseca, J., & Chávez-Velásquez, M. (2016). Influences of scale on bat habitat relationships in a forested landscape in Nicaragua. Landscape Ecology, 31(6), 1299–1318. https://doi.org/10.1007/s10980-016-0343-4
Chao, A., Chazdon, R. L., Colwell, R. K., & Shen, T. (2005). A new statistical approach for assessing similarity of species composition with incidence and abundance data. Ecology letters, 8(2), 148–159.
Charles-Dominique, P. (1986). Inter-relations between frugivorous vertebrates and pioneer plants: Cecropia, birds and bats in French Guyana. En Frugivores and seed dispersal (pp. 119–135). Springer.
Cleveland, C. J., Betke, M., Federico, P., Frank, J. D., Thomas, G., Horn, J., Kunz, T. H., López, J. D., Mccracken, G. F., Medellín, R. A., Moreno-valdez, A., Sansone, C. G., & Westbrook, J. K. (2006). Economic value of the pest control service provided by Brazilian free‐tailed bats in south‐central Texas. 4(5).
Dans Chavarría, A. (2014). Estado poblacional del Almendro (Dipteryx panamensis) como indicador de la disponibilidad de hábitat y del estado actual de poblaciones de Lapa Verde (Ara ambiguus) en 7 comunidades del Sureste de Nicaragua. URACCAN.
De Serres, G., Skowronski, D. M., Mimault, P., Ouakki, M., Maranda‐Aubut, R., & Duval, B. (2009). Bats in the Bedroom, Bats in the Belfry: Reanalysis of the Rationale for Rabies Postexposure Prophylaxis. Clinical Infectious Diseases. https://doi.org/10.1086/598998
Delavaux, C. (2013). Por qué es Importante la Conservación de los Murciélagos: El Éxito de la Agricultura y la Gestión de Biodiversidad Mundial. En Programa de conservación de murciélagos del Ecuador (Vol. 1).
Diaz, Mónica, Solari, S., Aguirre, L., Aguilar, L., & Barquez, R. (2016). Clave de Identificación de los Murciélagos de Sudamerica. En Publicación Especial N° 2, PCMA (Programa de Conservación de los Murciélagos de Argentina).
Espinoza, A., Aguirre, L., Swarner, M., & Emmons, L. (2004). Distribución de Vampyrum spectrum en Bolivia. Ecología en Bolivia.
Estrada-Villegas, S., Meyer, C. F. J., & Kalko, E. K. V. (2010). Effects of tropical forest fragmentation on aerial insectivorous bats in a land-bridge island system. Biological Conservation. https://doi.org/10.1016/j.biocon.2009.11.009
Faria, D. (2006). Phyllostomid bats of a fragmented landscape in the north-eastern Atlantic forest, Brazil. Journal of Tropical Ecology. https://doi.org/10.1017/S0266467406003385
Fenton, M. B., Acharya, L., Audet, D., Hickey, M. B. C., Merriman, C., Obrist, M. K., Syme, D. M., & Adkins, B. (1992). Phyllostomid bats (Chiroptera: Phyllostomidae) as indicators of habitat disruption in the Neotropics. Biotropica, 440–446.
Ferro Muñoz, N., Giraldo, A., Murillo García, O. E., & García, O. E. M. (2018). Composition, trophic structure and activity patterns of the understory bats of the Bitaco Forest Reserve. Acta Biológica Colombiana, 23(2), 170–178. https://doi.org/10.15446/abc.v23n2.64062
Fleming, T. H. (1986). Opportunism versus specialization: the evolution of feeding strategies in frugivorous bats. En Estrada A., Fleming T.H. (eds) Frugivores and seed dispersal. Tasks for vegetation science, vol 15. Springer, Dordrecht.
Flores-Saldaña, M. G. (2008). Estructura de las comunidades de murciélagos en un gradiente ambiental en la reserva de la biosfera y tierra comunitaria de origen pilon lajas, bolivia. Mastozoología Neotropical, 15(2), 309–322.
Fundación del Rio. (2012). Reserva Biológica Indio Maíz. Informe sobre acompañamiento a patrullaje.
FUNDAR. (2002). II Expedición Científica a la Reserva Biológica Indio Maíz: Estableciendo la base científico técnica para el plan de manejo. Informe Técnico final. MARENA, FUNDAR Amigos de la Tierra., 139.
Galindo-González, J., Guevara, S., & Sosa, V. J. (2000). Bat- and Bird-Generated Seed Rains at Isolated Trees in Pastures in a Tropical Rainforest. Conservation Biology, 14(6), 1693–1703. https://doi.org/10.1111/j.1523-1739.2000.99072.x
Galindo Gonzales, J. (1998). dispersion de semillas por murcielagos:su immportancia en la conservacion y regeneracion del bosque tropical. Acta Zoológica Mexicana. 73:57-74.
Galindo Gonzales, J. (2004). Clasificación de los murciélagos de la región de los tuxtlas, Veracruz, respecto a su respuesta a la fragmentación del hábitat. Acta Zoológica mexicana, 20:239-243.
Gorresen, P. M., & Willig, M. R. (2004). Landscape responses of bats to habitat fragmentation in Atlantic forest of Paraguay. Journal of Mammalogy, 85(4), 688–697.
Henry, M., Cosson, J. F., & Pons, J. M. (2007). Abundance may be a misleading indicator of fragmentation-sensitivity: The case of fig-eating bats. Biological Conservation. https://doi.org/10.1016/j.biocon.2007.06.024
IBM® Statistical SPSS®. (2016). IBM® SPSS® 23.0 (p. Statistical Package for the Social Sciences). http://www.spss.com/
Jaberg, C., & Guisan, A. (2001). Modelling the distribution of bats in relation to landscape structure in a temperate mountain environment. Journal of Applied Ecology, 38(6), 1169–1181.
Krebs, C. J. (1985). Ecología: estudio de la distribución y la abundancia (Número 574.5 K92e). México, MX: Edit. Harla.
MacSwiney G, M. C. (2010). Murciélagos. Biodiversidad y desarrollo humano en Yucatán. CICY, PPD-FMAM, Conabio, Seduma. Yucatan, México.
MARENA. (2007). IV informe del estado del ambiente en Nicaragua. 339.
Medellín, R. A., Equihua, M., & Amin, M. A. (2000). Bat diversity and abundance as indicators of disturbance in neotropical rainforest. Conservation Biology, 14(6), 1666–1675. https://doi.org/10.1046/j.1523-1739.2000.99068.x
Medellín, R., Arita, H., & Sánchez, O. (2008). Identificación de los murciélagos de México. Instituto de Ecología, UNAM: México, 78 pp.
Medina-Fitoria, A. (2014). Murciélagos de Nicaragua. Guía de campo (primera. ed.).
Medina, A, & Saldaña, O. (2012). Lista patrón de los mamíferos de Nicaragua. Managua FUNDAR, 40 p.
Medina, A., Harvey, C., Sánchez, D., Vílchez, S., & Hernández, B. (2007). Bat diversity and movement in a Neotropical agricultural landscape. Biotropica, 39(1), 120–128. https://doi.org/10.1111/j.1744-7429.2006.00240.x
Medina, A. & Martínez-Fonseca, J. (2019). Cronología histórica de la quiropterología en Nicaragua. Revista Mexicana de Mastozoología (Nueva Epoca). 9. 1. 10.22201/ie.20074484e.2019.9.2.286.
Montero, J., & Espinoza, C. (1999). Murciélagos Filostómidos (Chiroptera, Phyllostomidae) como indicadores del estado del hábitat en el Parque Nacional Piedras Blancas, Costa Rica. 1–24.
Moreno, C. (2001). Métodos para medir la biodiversidad. M&T-Manuales y Tesis SEA. vol. 1, Zaragoza. 84 pp.
Reid, F. (2009). Field Guide to the Mammals of Central América and Southeast México. Oxford University. United State from America.
Rodríguez-Herrera, B., & Sánchez, R. (2015). Estrategia centroamericana para la conservación de los murciélagos. Vol. XXXIII (1o, Número 2). Escuela de Biología, Universidad de Costa Rica. https://doi.org/10.1007/s13398-014-0173-7.2
Siu, E., Ebanks, B., Suárez, J., Ch, J., Saldaña, O., Aguirre., Y., & Rivas, E. (2018). Murciélagos del Centro de Transferencia (CeTAF), Bluefields, Nicaragua. Wani, 73, 59–64.
Tapia, O., & Ñamendy, M., & Martínez-Fonseca, J. (2020). First record of the Lesser Long-nosed Bat, Leptonycteris yerbabuenae Martinez & Villa-R., 1940 (Chiroptera, Phyllostomidae), in Nicaragua. Check List. 16. 451-456. 10.15560/16.2.451.
Sokal, R., & Rohlf, F. J. (1981). Biometry. Francisco, California, 259 p.
Sosa, V. J., Hernández-Salazar, E., Hernández-Conrique, D., & Castro-Luna, A. A. (2008). Murciélagos.
Timm, R. M., Laval, R. K., Rodríguez-H, B., La Val, R. K., & Rodriguez-Herrera, B. (1999). Clave de Campo para los murciélagos de Costa Rica. Brenesia, 52(1), 1–32.
WHittaker, R. H. (1970). Community and ecosystem. University of California., 162.
Zolotoff-Pallais, J., & Medina-Fitoria, A. (2005). Evaluación Ecológica Rápida (EER) Los Playones-Playa Madera Municipio de San Juan del Sur, Departamento de Rivas. 1–51.
© 2020 Revista Científica de FAREM-Estelí.
![]() Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
