Primeros registros de un pez dorosomátido y de un parásito metazoario de peces en la laguna de Masaya, Nicaragua
First records of a dorosomatid fish and a metazoan fish parasite in the Masaya lagoon, Nicaragua
Jeffrey K. McCrary
Universidad Nacional Autónoma de Nicaragua, Managua. UNAN-Managua, Nicaragua
https://orcid.org/0000-0002-5979-7400
jmccrary2@yahoo.com
María Isabel Jiménez-García
Tecnológico Nacional de México. Veracruz, México
https://orcid.org/0000-0003-2653-4927
mariaisabeljimenez@bdelrio.tecnm.mx
RECIBIDO
11/01/2024
ACEPTADO
30/04/2024
RESUMEN
A pesar de su importancia como hábitats de especies acuáticas prioritarias para medidas de conservación, la fauna de las lagunas cratéricas volcánicas en Nicaragua no es completamente caracterizada. Para ampliar la caracterización de su fauna acuática, se realizaron capturas de peces en la Laguna de Masaya utilizando redes y anzuelos, en dos períodos diferentes y en dos sitios distintos. Se realizó un análisis de tejidos de peces de tres taxones de peces capturados, para la identificación y cuantificación de parásitos metazoarios en la Laguna de Masaya. Este artículo científico reporta el primer registro del sabalete de Chávez, Dorosoma chavesi (Actinopterygii; Dorosomatidae), en la Laguna de Masaya, dentro del Parque Nacional Volcán Masaya, extendiéndose así su rango natural de distribución hacia el oeste de Nicaragua. La especie está registrada en la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN) como casi amenazada. Además, este informe presenta el primer registro del parásito metazoario Ascocotyle tenuicollis (Platyhelminthes; Heterophyidae) en la Laguna de Masaya. La especie fue encontrada en el corazón de Amphilophus cf. citrinellus y de Hypsophrys nematopus (ambas Actinopterygii; Cichlidae). No se encontraron parásitos metazoarios en el corazón, mesenterios, ni tracto intestinal de D. chavesi. Se recomienda implementar medidas de protección y monitoreo de especies en elevado estado de conservación en la Laguna de Masaya.
PALABRAS CLAVES
Dorosomatidae; sabalete de Chávez; Lista Roja; Platyhelminthes.
ABSTRACT
Despite their importance as habitats of priority aquatic species for conservation measures, the fauna of volcanic crater lakes in Nicaragua is not fully characterized. To extend the characterization of its aquatic fauna, fish captures were made in the Masaya Lagoon using nets and hooks, in two different periods and in two different sites. Fish tissue analysis of three fish taxa captured was carried out for the identification and quantification of metazoan parasites in the Masaya Lagoon. This scientific paper reports the first record of Chavez’s sabalete, Dorosoma chavesi (Actinopterygii; Dorosomatidae), in the Masaya Lagoon, within the Masaya Volcano National Park, thus extending its natural range to western Nicaragua. The species is registered in the Red List of the International Union for Conservation of Nature (IUCN) as Near Threatened. In addition, this report presents the first record of the metazoan parasite Ascocotyle tenuicollis (Platyhelminthes; Heterophyidae) in the Masaya Lagoon. The species was found in the heart of Amphilophus cf. citrinellus and Hypsophrys nematopus (both Actinopterygii; Cichlidae). No metazoan parasites were found in the heart, mesentery, or intestinal tract of D. chavesi. It is recommended to implement protection and monitoring measures for species in high conservation status in the Masaya Lagoon.
KEYWORDS
Dorosomatidae; Chavez’s sabalete; Red List; Platyhelminthes.
INTRODUCCIÓN
Con el avance del cambio climático, la demanda sobre recursos naturales y otras amenazas antropogénicas sobre las áreas naturales, se precisan programas de monitoreo y respuesta rápida en áreas donde habitan especies en riesgo de extinción. La urgencia de monitorear poblaciones de especies amenazadas es particularmente aguda en las llamadas islas biogeográficas, hábitats pequeños y aislados que pueden albergar especies endémicas de flora y fauna (Ricklefs & Bermingham, 2007; Kier et al., 2009; Rosindell & Fillmore, 2011). Sistemas lacustres naturales pueden albergar especies endémicas sensibles a impactos ambientales, y muchas veces desconocidas (Meixner et al., 2007; Verleyen et al., 2011).
Es imprescindible conocer los patrones de distribución natural de especies y las asociaciones naturales entre especies, para crear planes de desarrollo humano en armonía con las especies en riesgo, especialmente en áreas protegidas que incluyen la protección de flora y fauna entre sus objetivos. Sin embargo, los países en vías de desarrollo en el trópico, donde las economías no alcanzan a dar abasto a las necesidades básicas de sus pobladores, pueden enfrentar severas limitaciones en su capacidad técnica o en los recursos disponibles para desarrollar líneas de base completas en su biodiversidad, y en el monitoreo de las especies priorizadas en los puntos calientes de la biodiversidad (Collen et al. 2018).
Entre estos países se incluye Nicaragua, que alberga docenas de especies de fauna acuática con rangos muy reducidos, especialmente dentro de la cuenca del Río San Juan y sus lagunas cratéricas volcánicas aledañas (Villa, 1982; Waid et al., 1999; Geiger et al., 2010).
Esta cuenca y las lagunas cratéricas han recibido atención de científicos recientemente, por el complejo patrón de especiación en el grupo de especies de la mojarra común, una vez considerada una sola especie, Amphilophus citrinellus (Actinopterygii; Cichlidae), ahora reconocida como un grupo de hasta docenas de especies, de las cuales solo once han recibido descripciones oficiales hasta la fecha (McCrary, 2016). Las poblaciones de este grupo que habitan la Laguna de Masaya presentan patrones filogenéticos de múltiples especies endémicas al sitio (Barluenga & Meyer, 2010; Geiger et al., 2010); sin embargo, todavía no han recibido descripciones formales.
Otra especie de reducido rango natural que habita esta cuenca es el “sabalete de Chávez”, Dorosoma chavesi (Actinopterygii; Dorosomatidae). En su revisión del género Dorosoma, Miller (1950), comentó que la especie fue conocida únicamente en los Lagos Xolotlán y Cocibolca. Astorqui (1971), confirmó su presencia en estos lagos, y luego su rango conocido fue extendido a la Laguna de Xiloá (Villa, 1982) y a la Laguna Monte Galán (Waid et al., 1999), y a cuencas que alimentan al Lago Cocibolca y el Río San Juan desde el sur desde Costa Rica (Angulo et al., 2013).
Recientemente, el estado de conservación de D. chavesi en la Lista Roja fue elevado a la categoría casi amenazada (NT; IUCN, 2024). El desarrollo de una estrategia para la protección de las poblaciones de la especie requiere mejor información sobre su distribución, abundancia y otros aspectos ecológicos, como las relaciones que presente con organismos simbiontes.
La fauna de parásitos metazoarios asociados con los peces es cada vez más reconocida como un elemento de biodiversidad en sí (Sorci et al., 2016). Sin embargo, las parasitosis y enfermedades también pueden comprometer la salud de sus peces hospederos y manifestar síntomas de ecosistemas afectadas por alteraciones, por lo que la carga parasitaria puede incidir en casos de metazoarios (Marcogliese 2005). La biodiversidad y la estructura poblacional de los parásitos metazoarios en un sistema acuático pueden ser sensibles a cambios ambientales (Budria, 2017). La diversidad de parásitos metazoarios asociados con peces continentales en todo Nicaragua fue revisada recientemente, revelando un total de 101 taxones registrados en el país (Santacruz et al., 2022a).
Descripción de Sitio
La Laguna de Masaya (superficie 8,4 km2; Waid et al., 1999) es una laguna volcánica cratérica, ubicada dentro de la caldera de Volcán Masaya, en el Departamento Masaya en Nicaragua. Se encuentra a siete km NO de Laguna de Apoyo, 16 km O del Lago Cocibolca, y 20 km S del Lago Xolotlán (Figura 1). La Laguna de Masaya no tiene comunicación de agua superficial con otro cuerpo de agua.
Figura 1
Mapa de Laguna de Masaya, Nicaragua
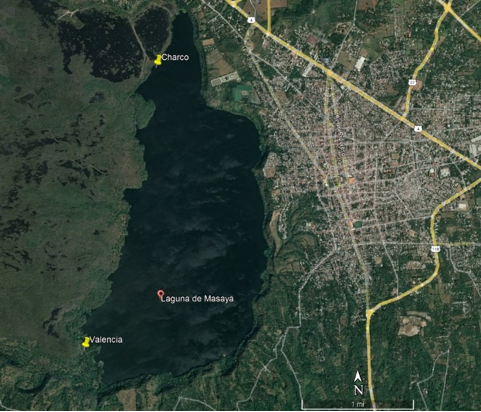
Nota: El Charco: N 11,9893°, O 86,1193°; Playa Valencia: N 11,9531°, O 86,1290°. La ciudad de Masaya es al este de la Laguna.
Once taxones de peces han sido documentados en la Laguna de Masaya (Waid et al., 1999). Las formas del grupo A. cf. citrinellus en esta laguna son genéticamente distintas de las demás formas en otros sitios (Geiger et al., 2010; Barluenga y Meyer, 2010). Más recientemente, análisis parasitológicos de peces encontraron nueve taxones de parásitos metazoarios en peces de este sitio, en análisis de cuatro taxones de peces: Hypsophrys nematopus y Criboheros longimanus (ambas Actinopterygii; Cichlidae), A. cf. citrinellus y Gobiomorus dormitor (Actinopterygii; Eleotridae) (Santacruz et al., 2022a; 2022b).
La Laguna de Masaya se encuentra afectada desde la década de los 1970 por vertientes de aguas residuales municipales inadecuadamente tratadas, las que han afectado a la transparencia y los parámetros físico-químicos de sus aguas (Barlow et al., 1976; Fuentes Peña, 2019; MARENA, 2014). El fitoplancton de Laguna de Masaya no presenta altas concentraciones de microcistinas, pero es dominado por cianobacterias la mayor parte del año, exceptuando los meses de junio y julio, al inicio de la estación lluviosa, cuando dominan diatomeas (Hernández González et al., 2018).
Barlow (1976) comentó que el agua de esta laguna cratérica fue una vez lo suficientemente transparente para facilitar observaciones directas de peces ocupando SCUBA, ya que él mismo realizaba investigaciones en 1965; sin embargo, por 1976, él menciona, la introducción de aguas servidas municipales de la ciudad vecina Masaya afectaba dramáticamente la visibilidad subacuática en la laguna, ya de carácter eutrófico.
En el presente artículo se presentan resultados de una investigación sobre la fauna acuática en un sitio natural de Nicaragua, con resultados que incluyen ampliaciones de rango geográfico de una especie de pez y de una especie de parásito metazoario de peces, ambas en una laguna cratérica en los alrededores de la cuenca del Río San Juan en Nicaragua. Se presentan algunos aspectos respecto de la conservación de D. chavesi.
MATERIALES Y MÉTODOS
Se llevó una investigación de carácter mixta que involucraba captura de peces, identificaciones preliminares de especies, y luego una revisión cualitativa y cuantitativa de parásitos en tejidos de los peces. El estudio se condujo sobre los peces en dos sitios en la Laguna de Masaya.
Etapas de investigación
Etapa 1. La Tabla 1 presenta los detalles metodológicos de los muestreos y observaciones. Peces capturados el 8 de enero del 2008 fueron puestos sobre hielo y luego revisados para la presencia de parásitos o evidencia de patologías en el lumen del intestino, mesenterio, hígado, bazo y corazón. Se ocupó un microscopio compuesto (10X) contabilizando a los quistes de parásitos metazoarios en el corazón de sus hospederos.
Tabla 1
Muestreos de Peces en la Laguna de Masaya.
| Fecha | Sitio | Profundidad, Fondo | Tipo de muestreo |
|---|---|---|---|
| 27 febrero 2007 | El Charco | 0-1,5 m, arenoso | Chinchorro |
| 8 enero 2008 | El Charco | - | Observación desde la orilla sin pescar |
| 8 enero 2008 | Venecia | 0-1,5 m, arenoso | Chinchorro, red de agalla 2 cm apertura |
| 6 enero 2010 | Venecia | 0-1,5 m, arenoso | Chinchorro, anzuelo |
| 22 noviembre 2018 | Venecia | - | Observación visual desde la orilla sin pescar |
Nota: Véase el mapa Figura 1 para la ubicación de los sitios.
Etapa 2. Los individuos capturados el 6 de enero del 2010 fueron sometidos a la eutanasia mediante su inmersión en una solución de agua con aceite de clavo de olor a diez gotas por litro, preservados en formalina al 10% y luego lavados con agua y puestos en 70% etanol.
Ambos métodos de manejo de muestras conforman a las indicaciones para eutanasia de peces para uso investigativo (AVMA 2020).
Cálculos Estadísticos
Las estadísticas de abundancias de parásitos presentadas son de medias y las variaciones se reportan como desviación estándar.
RESULTADOS Y DISCUSIÓN
La presencia de D. chavesi fue documentada por primera vez en una actividad de captura de peces dedicada a otra especie, en la fecha 27 febrero 2007, en un punto llamado El Charco en el norte de la Laguna de Masaya (Figura 1). Los individuos de D. chavesi fueron regresados al lago, después de anotar su presencia en el sitio. Se capturaron varios individuos de D. chavesi vivos el 8 de enero del 2008, en la superficie del agua cerca de la orilla en El Charco, donde también se observaron docenas de individuos muertos, pero no se sabe cuáles causas podrían ser involucradas en los eventos de mortandad (Figura 2).
Figura 2
El Charco, Laguna de Masaya, 8 de enero del 2008.

Nota: Grandes cantidades de peces muertos, entre ellos, muchos individuos de D. chavesi. Foto por MI Jiménez-García.
Ningún parásito metazoario fue encontrado en los tejidos analizados en seis individuos de D. chavesi. En contraste, varios taxones de parásitos fueron encontrados en los siguientes tejidos de juveniles de ambos taxones de los peces cíclidos A. cf. citrinellus de y H. nematopus: corazón, mayormente en el bulbo arterial (Ascocotyle tenuicollis (Trematoda; Heterophyidae)); mesenterio (metacercariae sp. 1 (Trematoda)); intestino (trematodo sp. adulto no identificado (Trematoda)). Además, hubo parásitos (metacercariae sp. 2 (Trematoda)) en la pared del intestino de un individuo de A. cf. citrinellus, y se encontró al adulto Crassicutis sp. en el intestino de un individuo de H. nematopus. De los diez y siete individuos de peces cíclidos analizados, se encontraron parásitos metazoarios en los tejidos de ocho individuos (Tabla 2).
Tabla 2
Parásitos y patologías y contenidos estomacales de peces en la laguna de Masaya.
| Taxon | Ascocotyle tenuicollis | Metacercaria sp. 1 | Metacercaria sp. 2 | Crassicutis sp. | Trematodo adulto sp. | Contenidos estomacalesc |
|---|---|---|---|---|---|---|
| Sitio de infección | Corazón | Mesenterio | pared intestino | intestino | intestino | |
| Amphilophus cf. citrinellum N = 8 a 88 ± 26 mm b |
12 1 ± 3 0-8 |
12 0,4 ± 1 0-4 |
12 5 ± 14 0-40 |
0 0 0 |
12 0,1 ± 0.3 0-1 |
Vacío 60 Diatomeas 40 Ostrácodos 13 Oligoquetos 13 Larvas insectos 13 |
| Hypsophrys nematopus N = 9 a 73± 10 mm b |
55 22 ± 29 0-75 |
11 0,3 ± 1 0-3 |
0 0 0 |
11 0,1 ± 0.3 0-1 |
22 0,4 ± 1 0-3 |
Vacío 44 Diatomeas 56 Ostrácodos 22 Oligoquetos 11 Larvas insectos 11 |
| Dorosoma chavesi N = 6 a 93 ± 16 mm b |
0 0 0 |
0 0 0 |
0 0 0 |
0 0 0 |
0 0 0 |
Vacío 100 |
Nota: los parámetros de infección: porcentaje de prevalencia (primer renglón), y abundancia media ± desviación estándar (segundo renglón), e intervalo del número de parásitos por individuo (tercer renglón).
a el tamaño de muestra (N).
b la longitud estándar de los peces examinados con su desviación estándar.
c Cada elemento de contenido estomacal (y vacío) se presenta con el porcentaje de individuos que lo presentó.
Diatomeas dominaron los contenidos estomacales de los A. cf. citrinellus y H. nematopus, siendo individuos juveniles; no se encontraron alimentos identificables en los individuos de D. chavesi (Tabla 2).
Docenas de individuos de D. chavesi fueron capturados el 6 de enero del 2010 en la playa Venecia (Figura 3). Además de preservar diez individuos, algunos fueron ocupados como carnada en anzuelo, pescando exitosamente a cinco individuos de A. cf. citrinellus en El Charco el mismo día. El 22 noviembre del 2018 dos individuos de D. chavesi fueron observados, ambos individuos capturados y consumidos por una Garza Real (Ardea alba (Aves: Ardeidae)), en agua de aproximadamente 30 cm de profundidad en la Playa Venecia (Figura 4).
Figura 3
Playa Venecia, Laguna de Masaya.

Nota: Varios individuos de Dorosoma chavesi capturados el 6 de enero del 2010. Foto por MF Geiger.
Figura 4
Playa Venecia, Laguna de Masaya.

Nota: Una Garza Real (Ardea alba Linnaeus,1758) con un individuo de Dorosoma chavesi en su pico, el 22 de noviembre del 2018. Foto por JK McCrary.
Se presentó el primer registro de D. chavesi en la Laguna de Masaya, confirmada con fotografías de ejemplares capturados en distintas ocasiones y de observaciones de peces muertos y de individuos de parte de un ave. También, proporcionan evidencia de una población sostenida, siendo de múltiples individuos en varias fechas extendiendo por más de una década, y en dos sitios apartados en el cuerpo de agua. Consideramos que su presencia simplemente fue obviada en muestreos anteriores, siendo que la especie no fue el sujeto de los estudios. Este hallazgo extiende el rango conocido de D. chavesi hacia el oeste: La Laguna de Masaya es el primero cuerpo de agua al oeste del Lago Cocibolca en donde se registra la especie.
Esta laguna cratérica es la tercera que presenta poblaciones de D. chavesi; las otras son Xiloá y Monte Galán, ambas ubicadas aproximadamente a un kilómetro de distancia de las orillas del Lago Xolotlán. Hay cinco lagunas volcánicas cratéricas más en Nicaragua que gozan de revisiones de su fauna acuática sin haber resultado registro de su presencia (Waid et al. 1999). Ya que D. chavesi goza de elevada categoría de conservación en la Lista Roja, como antes mencionada, su presencia en la Laguna de Masaya conlleva una elevada importancia en la protección del sitio como hábitat de fauna acuática.
Esta especie se agrega a dos más encontradas en la Laguna de Masaya con elevado estado de conservación, Atherinella sardina (Actinopterygii; Atherinopsidae) como Vulnerable y H. nematopus como Casi Amenazada (Tabla 3). La Laguna de Masaya es parte del Parque Nacional Volcán Masaya, regido por del Sistema Nacional de Áreas Protegidas del Ministerio de Recursos Naturales y Ambiente del Gobierno de Nicaragua. Sin embargo, ninguna medida propuesta en su Plan de Manejo es dirigida al monitoreo ni a la protección de las poblaciones de peces en este cuerpo de agua (MARENA, 2014).
Tabla 3
Taxones de Peces en la Laguna de Masaya.
| Familia | Taxón | Estado de Conservación |
|---|---|---|
| Dorosomatidae | Dorosoma chavesi Meek, 1907 | NT |
| Poeciliidae | Poecilia sphenops Valenciennes, 1846 | LC |
| Poeciliidae | Poecilia sp. | NE |
| Atherinopsidae | Atherinella sardina (Meek, 1907) | VU |
| Cichlidae | Amphilophus cf. citrinellus (Günther, 1864) | NE |
| Cichlidae | Amphilophus labiatus (Günther, 1864) | NE |
| Cichlidae | Parachromis dovii (Günther, 1864) | LC |
| Cichlidae | Parachromis managuensis (Günther, 1867) | LC |
| Cichlidae | Criboheros longimanus (Günther, 1867) | LC |
| Cichlidae | Hypsophrys nematopus (Günther, 1867) | NT |
| Cichlidae | Hypsophrys nicaraguensis (Günther, 1864) | LC |
| Eleotridae | Gobiomorus dormitor Lacepède, 1800 | LC |
Nota: El estado de conservación, según la Lista Roja (IUCN 2024). Leyenda: NT-Casi Amenazada; LC-Preocupación Menor; VU-vulnerable; NE-no evaluada. Los taxones de peces son reportados anteriormente en Waid et al. (1999), exceptuando D. chavesi, con primer reporte en el presente estudio.
Dorosoma chavesi fue la especie más abundante presente en capturas en barco de rastreo en aguas abiertas del Lago Cocibolca (Martínez 1976), pero de reducida abundancia cerca de la costa en aguas someras (Martínez 1976; Hernández-Portocarrero y Saborido-Rey 2008). Su rango puede ser limitado por factores biogeográficas, tales como la falta de hábitat suficientemente léntico, lo que puede explicar su ausencia de la zona de la Estación Biológica de La Selva, en la cuenca del Río San Juan en Costa Rica (Bussing 1994).
La presencia de D. chavesi puede figurar en la ecología de la Laguna de Masaya como alimento a otras especies. Villa (1982) nota que D. chavesi es el pez de mayor abundancia entre los contenidos estomacales del róbalo Centropomus parallelus (Actineroptygii; Centropomidae), en el Lago Nicaragua. Además, Barlow (1976) menciona que Riedel (1964) registra a D. chavesi como componente de la dieta de A. cf. citrinellus. El éxito en pescar a A. cf. citrinellus con anzuelo utilizando D. chavesi como cebo, apunta a que la predación de parte de peces puede ejercer algún nivel de control trófico sobre esa especie existe en todo su rango natural.
Entre las mayores distinciones entre los dos lagos Cocibolca y Xolotlán, es la presencia de ciertos peces predadores, como el tiburón toro Carcharhinus leucas (Chondrichthyes; Carcharhinidae), el pez sierra Pristis pristis (Chondrichthyes; Pristidae), y el sábalo Megalops atlanticus (Actinopterygii; Megalopidae), en el Lago Cocibolca, pero no en el Lago Xolotlán, la que puede impactar a las poblaciones de peces planctívoros (Ahlgren et al. 2000). Tristemente, dos de las tres especies predadoras mencionadas se encuentran efectivamente eliminadas del Lago Cocibolca desde cuatro décadas atrás (Thorson 1982).
Los miembros del género Dorosoma son conocidos por finas branquiespinas especializadas para filtrar alimentos finos del lodo del sustrato (Miller 1960). Los componentes estomacales de D. chavesi en el Lago Xolotlán fueron dominados por rotíferos durante la mayor parte del año; durante los meses diciembre y enero, los componentes principales de dieta se dividieron entre rotíferos y ostrácodos, y otros componentes planktónicos se presentaron en menor rango (Vela 1991). Poblaciones de D. chavesi podrían ejercer un papel significativo en el control de las poblaciones de zooplancton (Ahlgren et al. 2000).
Entre noviembre y enero comienzan los vientos de la entrada de verano, provocando que la Laguna de Masaya sufra eventos de mortandad masiva de peces. Por ejemplo, hubo un evento el 19 de diciembre del 2006, durante el cual incontables números de peces boquean a la superficie y miles de peces muertos se observan en la orilla y sobre la superficie (JKM observación personal). Este evento también fue documentado durante el 4-8 de enero del 2008, y se identificaron muchos individuos de D. chavesi muertos (Figura 2). Las posibles causas de este evento, entre ellas parasitosis, no han sido esclarecidos por esta investigación.
Las especies de Dorosoma son centinelas por su sensibilidad a cambios ambientales, y algunas han servido como indicadores de contaminación por cianobacterias (Acuña et al. 2020). Se considera que la mortandad de la temporada de inicio del verano puede tener una combinación de causas, entre ellas la introducción de contaminantes de una vertiente de aguas domésticas no adecuadamente tratadas desde Masaya y desechos sólidos desde varias comunidades (MARENA 2014; Figuras 3 y 4).
Además de agregar una especie al registro de peces en Laguna de Masaya, se reporta un registro nuevo de especie de parásito trematodo, A. tenuicollis. Individuos de esta especie fueron encontrados en el corazón, particularmente en el bulbo arterial, de sus hospederos. También se encontró en uno de los ocho individuos de A. cf. citrinellus analizados y en cinco de los nueve individuos analizados de H. nematopus (Tabla 2), ampliando la lista de parásitos metazoarios reportados recientemente en este sitio a siete taxones identificadas a nivel de especie (Tabla 4).
Tabla 4.
Listado de parásitos metazoarios de peces en la Laguna de Masaya.
| Grupo | Taxón | Pez hospedero | Tejido involucrado | Fuente |
|---|---|---|---|---|
| Trematoda | Ascocotyle tenuicollis Looss, 1899 | Amphilophus cf. citrinellus | Corazón | Z |
| Hypsophrys nematopus | Corazón | Z | ||
| Trematoda | Crassicutis cichlasomae Manter, 1938 | Amphilophus cf. citrinellus | Intestino | Y |
| Criboheros longimanus | Intestino | Y | ||
| Trematoda | Crassicutis sp. | Amphilophus cf. citrinellus | Intestino | Z |
| Trematoda | Oligogonotylus manteri Watson, 1976 | Amphilophus cf. citrinellus Hypsophrys nematopus |
Intestino | Y |
| Trematoda | Posthodiplostomum spp. | Hypsophrys nematopus | a | Y |
| Monogenea | Sciadicleithrum mexicanum Kritsky, Vidal-Martinez & Rodríguez-Canul, 1994 | Amphilophus cf. citrinellus | Agalla | Y |
| Monogenea | Sciadicleithrum nicaraguense Vidal-Martínez, Scholz & Aguirre-Macedo, 2001 | Criboheros longimanus | Agalla | Y |
| Acanthocephala | Neoechinorhynchus costarricense Pinacho-Pinacho et al., 2018 | Amphilophus cf. citrinellus | Intestino | Y |
| Nematoda | Contracaecum sp. | Gobiomorus dormitor | Mesenterio | X |
| Nematoda | Contracaecum sp. / Hysterothylacium sp. b | Amphilophus cf. citrinellus | Mesenterio | Y |
| Criboheros longimanus | Mesenterio | Y | ||
| Nematoda | Procamallanus barlowi Santacruz, Barluenga & Pérez-Ponce de León, 2021 | Criboheros longimanus | Intestino | Y |
Nota: X-Santacruz et al. 2022a; Y-Santacruz et al. 2022b; Z-este reporte.
a músculo o mesenterio sin especificar.
b dos taxones sin especificar.
No existen previos reportes de análisis de parásitos de D. chavesi, pero se han publicado parásitos metazoarios en el congénero Dorosoma cepedianum en tres diferentes estudios: dos especies de céstodos (Brooksby et al. 2017); una especie de acantocéfalo (Williams & Gaines 1974); varias especies de nemátodos y una especie de acantocéfalo (Wilcox 2013).
La íctiofauna de las lagunas cratéricas y los Grandes Lagos de Nicaragua son laboratorios de la teoría de la biogeografía de islas de MacArthur y Wilson (Waid et al. 1999; Whitaker et al. 2017). Su cercanía al Lago Cocibolca parece ser factor en ser hábitat de el alto número de taxones de peces, relativo a otras lagunas cratéricas (Tabla 3; Waid et al. 1999). Además, algunos grupos de la íctiofauna de estos sitios sufren procesos evolutivos rápidos, resultando en numerosas especies, en su mayoría no descritas, especialmente entre el grupo A. cf. citrinellus (Geiger et al. 2010; Barluenga y Meyer 2010).
A pesar del fenómeno evolutivo demostrado en otros grupos de peces, se ha dirigido poca atención a los estados taxonómicos de otros taxones de peces, tales como D. chavesi. Miller (1950) consideró que las diferencias morfológicas entre individuos de D. chavesi en el Lago Xolotlán y los en el Lago Cocibolca podrían ser analizadas a mayor detalle, para confirmar si realmente son la misma especie o si algún proceso de especiación alopátrica estaría resultando (Kier et al. 2009).
Por ejemplo, sus congéneros Dorosoma petenense y Dorosoma anale presentan patrones linajes genético-moleculares en diferentes regiones de su rango (Elias et al. 2022; Macossay-Cortez et al. 2022). Las poblaciones de D. chavesi da cada cuerpo de agua que habita, ameritan comparación morfológica y molecular.
Las muestras preservadas de D. chavesi que resultan del presente estudio no se han depositado en ninguna colección de referencia hasta la fecha. El material paratipo ocupado por Miller (1950) se encuentra en el Chicago Natural History Museum y United States National Museum, ambos en Estados Unidos (Miller 1950). El espécimen holotipo es No. 5928, F.M.N.H., en el Chicago Natural History Museum (Meek 1907).
Los especímenes de D. chavesi del presente estudio se mantienen en colección privada (JKM colección personal) en espera de recibir una invitación de alguna colección para depositarlos. No existe una colección de referencia de biodiversidad en Nicaragua. Se recomienda crear un centro permanente nacional de referencia para entender y proteger la biodiversidad nacional.
CONCLUSIONES
Este nuevo registro de D. chavesi en la Laguna de Masaya, subraya la deficiente cobertura en conocimiento de la distribución de fauna acuática en Nicaragua. Este hallazgo demuestra la necesidad de repetidos muestreos y monitoreos periódicos de la fauna en todos los cuerpos de agua de importancia a la biodiversidad en el país. Se recomienda implementar medidas de monitoreo y protección de D. chavesi y los otros taxones mencionados en la Lista Roja como parte de la estrategia y los objetivos de protección de los recursos de patrimonio nacional. Aunque no fue encontrado ningún enlace de causa por la muerte de peces en la Laguna de Masaya, los riesgos de eventos de muerte masiva a poblaciones de peces en elevado estado de conservación ameritan una consideración particular (Tabla 3).
Este reporte presenta la primera documentación de análisis de tejidos de D. chavesi para la presencia de parásitos. La ausencia de parásitos metazoarios puede ser un factor importante en su éxito de colonización en esta laguna, por el momento, descarta la posibilidad de que cargas parasitarias altas en tejidos como el bulbo arterial del corazón pudieran ser un factor asociado con las mortalidades de D. chavesi observadas. Por otro lado, la identificación de A. tenuicollis en individuos de A. cf. citrinellus y en H. nematopus amplían el registro de parásitos metazoarios de peces encontrados en la Laguna de Masaya.
Este estudio fue elaborado con el apoyo estratégico de DANIDA y GTZ, y coordinaciones con la Procuraduría Ambiental de Nicaragua el Parque Nacional Volcán Masaya, permisos de investigación del Ministerio de Ambiente y Recursos Naturales y la promoción y el apoyo del Padre Miguel d’Escoto Brockmann (q.e.p.d.). Adicional apoyo vital en muestreos y logística fue aportado por M. Hogencamp, M. F. Geiger, M. Persicke, F. Schmidt, L. Paiz y A. M. Sutton.
REFERENCIAS BIBLIOGRÁFICAS
Acuña, S., Baxa, D., Lehman, P., Teh, F. -C., Deng, D. -F. & Teh, S. (2020). Determining the exposure pathway and impacts of Microcystis on threadfin shad, Dorosoma petenense, in San Francisco estuary. Environmental Toxicology, 39(4), 787-798. https://doi.org/10.1002/etc.4659
Ahlgren, I., Erikson, R., Moreno, L., Pacheco, L., Montenegro-Guillén, S. & Vammen, K. (2000). Pelagic food web interactions in Lake Cocibolca, Nicaragua. Verh. Internat. Verein. Limnol., 27(4), 1740-1746. https://doi.org/10.1080/03680770.1998.11901540
Angulo, A., Garita-Alvarado, C. A., Bussing, W. A. & López, M. I. (2013). Annotated checklist of the freshwater fishes of continental and insular Costa Rica: additions and nomenclatural revisions. Check List, 9(5), 987-1019. https://doi.org/10.15560/9.5.987
Astorqui, I. (1971). Peces de la cuenca de los grandes lagos de Nicaragua. Rev. Biol. Trop., 19, 7-57.
AVMA (2020). AVMA Guidelines for the Euthanasia of Animals. American Veterinary Medical Association. Schaumberg, IL USA. https://www.avma.org/sites/default/files/2020-02/Guidelines-on-Euthanasia-2020.pdf
Barlow, G. W. (1976). The Midas Cichlid in Nicaragua. En T. B. Thorson (Ed.), Investigations of the Ichthyofauna of Nicaraguan Lakes (Páginas 333-358). University of Nebraska-Lincoln, Lincoln, Nebraska, EEUU.
Barlow, G. W., Baylis, J. R. & Roberts, J. (1976). Chemical analyses of some crater lakes in relation to adjacent Lake Nicaragua. En T.B. Thorson (Ed.) Investigations of the Ichthyofauna of Nicaraguan Lakes (Páginas 17-20). University of Nebraska-Lincoln, Lincoln, Nebraska, EEUU.
Barluenga, M. & Meyer, A. (2010). Phylogeography, colonization and population history of the Midas cichlid species complex (Amphilophus spp.) in the Nicaraguan crater lakes. BMC Evolutionary Biology, 10, Artículo 326. https://doi.org/10.1186/1471-2148-10-326
Brooksby, A. M., Oguz, M. C. & Belk, M. C. (2017). A first survey of metazoan parasites in the fishes of Lake Powell, Utah. Western North American Naturalist, 77(1), 51-62. https://doi.org/10.3398/064.077.0107
Budria, A. (2017). Beyond troubled waters: the influence of eutrophication on host–parasite interactions. Functional Ecology, 31(7), 1348-1358. https://doi.org/10.1111/1365-2435.12880
Bussing, W.A. (1994). Ecological aspects of the fish community. En L. A. McDade et al., (Eds.) La Selva, Ecology and Natural History of a Tropical Rain Forest (Páginas 195-198). University of Chicago, Chicago, EEUU.
Collen, B., Ram, M., Zamin, T. & McRae, L. 2008. The tropical biodiversity data gap: addressing disparity in global monitoring. Tropical Conservation Science, 1(2), pp.75-88. https://doi.org/10.1177/1940082908001002
Elias, D. J., McMahan, C. D. & Piller, K. D. (2022). Molecular data elucidate cryptic diversity within the widespread Threadfin Shad (Dorosoma petenense: Clupeidae) across the Nearctic and Northern Neotropics. Hydrobiologia, 849, 89-111.
Fuentes Peña, C. (2019). Algunas consideraciones sobre 30 años de registro de parámetros físico-químicos del Lago Masaya, Nicaragua. Revista Científica Agua y Conocimiento, 5, 44-64.
Geiger, M. F., McCrary, J. K. & Schliewen, U. K. (2010). Not a simple case–A first comprehensive phylogenetic hypothesis for the Midas cichlid complex in Nicaragua (Teleostei: Cichlidae: Amphilophus). Molecular Phylogenetics and Evolution, 56(3), 1011-1024. https://doi.org/10.1016/j.ympev.2010.05.015
Hernández González, S.E., Ahlgren, I. & Ahlgren, G (2018). Fluctuaciones temporales en el fitoplancton y contenido de microcistinas intracelulares en cuatro lagos nicaragüenses. Revista Científica Agua y Conocimiento, 4, 1-10.
Hernández-Portocarrero, A. & Saborido-Rey, F. (2008). Abundancia relativa de los peces en la costa oriental del lago de Nicaragua. Ministerio del Ambiente y Recursos Naturales, Managua, Nicaragua. 146 páginas.
IUCN (2024). The IUCN Red List of Threatened Species. Versión 2023-1. https://www.iucnredlist.org
Kier, G., Kreft, H., Lee, T. M., Jetz, W., Ibisch, P. L., Nowicki, C., Mutke, J. & Barthlott, W. (2009). A global assessment of endemism and species richness across island and mainland regions. Proceedings of the National Academy of Sciences, 106(23), 9322-9327. https://doi.org/10.1073/pnas.0810306106.
Macossay-Cortez, A., Rodilez-Hernández, R., González-Díaz, A. A., Ornelas-García, C. P. & González-Acosta, A. F. (2022). Intraspecific morphological variation in shads, Dorosoma anale and D. petenense (Actinopterygii: Clupeiformes: Clupeidae), in the Mexican Grijalva and Usumacinta river basins. Acta Ichthyologica et Piscatoria, 52(2), 149-158. https://DOI.org/10.3897/aiep.52.84694
Marcogliese, D. J. (2005). Parasites of the superorganism: Are they indicators of ecosystem health? International Journal for Parasitology, 35, 705-716. https://doi.org/10.1016/j.ijpara.2005.01.015
MARENA (2014). Plan de Manejo Parque Nacional Volcán Masaya. Ministerio de Recursos Naturales y Ambiente, Managua. 94 páginas.
Martínez, S. C. (1976). Relative abundance and distribution of the Mojarra (Cichlasoma citrinellum) in Lake Nicaragua. En T. B. Thorson (Ed.), Investigations of the Ichthyofauna of Nicaraguan Lakes (Páginas 371-374), University of Nebraska-Lincoln, Lincoln, Nebraska, USA.
McCrary, J.K. 2016. Los peces de Laguna de Apoyo. Revista Estudios Ambientales, 2, 11-45.
Meek, S. E. (1907). Synopsis of the fishes of the Great Lakes of Nicaragua. Field Columbian Museum Publication 121 Zoological Series, 7, 97-132.
Meixner, M. J., Lüter, C., Eckert, C., Itskovich, V., Janussen, D., von Rintelen, T., Bohne, A. V., Meixner, J. M. & Hess, W. R. (2007). Phylogenetic analysis of freshwater sponges provide evidence for endemism and radiation in ancient lakes. Molecular Phylogenetics and Evolution, 45(3), 875-886. https://doi.org/10.1016/j.ympev.2007.09.007
Miller, R. R. (1950). A review of the American Clupeid fishes of the genus Dorosoma. Proceedings of the United States National Museum, 100, 387-410.
Ricklefs, R. E. & Bermingham, E. (2007). The West Indies as a laboratory of biogeography and evolution. Philosophical Transactions of the Royal Society of London B, 363(1352), 2393-2413. https://doi.org/10.1098/rstb.2007.2068
Rosindell, J. & Phillimore, A. B. (2011). A unified model of island biogeography sheds light on the zone of radiation. Ecology Letters, 14(6), 552-560. https://doi.org/10.1111/j.1461-0248.2011.01617.x
Santacruz, A., Barluenga, M. & Pérez-Ponce de León, G. (2022a). Filling the knowledge gap of Middle American freshwater fish parasite biodiversity: metazoan parasite fauna of Nicaragua. Journal of Helminthology, 96, Artículo e24. https://doi.org/10.1017/S0022149X2200013X
Santacruz, A., Barluenga, M. & Pérez-Ponce de León, G. (2022b). The macroparasite fauna of cichlid fish from Nicaraguan lakes, a model system for understanding host–parasite diversification and speciation. Scientific Reports, 12(1), Artículo 3944. https://doi.org/10.1038/s41598-022-07647-w
Sorci, G., Guivier, E., Lippens, C. & Faivre, B. (2016). Microbes, parasites and immune diseases. En A. Alvergne et al., (Eds.) Evolutionary thinking in medicine: From research to policy and practice (Páginas 211-223), Springer, Londres, Reino Unido.
Thorson, T. B. (1982). The impact of commercial exploitation on sawfish and shark populations in Lake Nicaragua. Fisheries, 7(2), 2-10. https://doi.org/10.1577/1548-8446(1982)007<0002:TIOCEO>2.0.CO;2
Vela, L. (1991). Natural diet of fish from Lake Xolotlán (Managua). Hydrobiological Bulletin, 25, 169-172. https://doi.org/10.1007/BF02291250
Verleyen, E., Hodgson, D. A., Gibson, J., Imura, S., Kaup, E., Kudoh, S., De Wever, A., Hoshino, T., McMinn, A., Obbels, D. & Roberts, D. (2012). Chemical limnology in coastal East Antarctic lakes: monitoring future climate change in centres of endemism and biodiversity. Antarctic Scien, 24(1), 23-33. https://doi.org/10.1017/S0954102011000642
Villa, J. (1982). Peces Nicaragüenses de Agua Dulce. Managua, Nicaragua, Fondo de Promoción Cultural del Banco de América. 253 páginas.
Waid, R., Raesly, R. L., McKaye, K. R. & McCrary, J. K. (1999). Zoogeografía íctica de lagunas cratéricas de Nicaragua. Encuentro, 51, 65-80.
Whitaker, R. J., Fernández-Palacios, J. M., Matthews, T. J., Borregaard M. K. & Triantis, K. A. (2017). Island biogeography: Taking the long view of nature’s laboratories. Science, Artículo 357:eaam8326. https://doi.org/10.1126/science.aam8326
Wilcox, J. (2013). Parasites of Invasive Carp and Native Fish in the Wabash River. Tesis de Maestría, Eastern Illinois University, Charleston, Illnois, EEUU. 61 páginas.
Williams, E.H., Jr. & Gaines, J.L., Jr. (1974). Acanthocephala of fishes from marine and brackish waters of the Mobile Bay region. Journal of Marine Science (Alabama), 2, 135-148.
© 2024 Revista Científica Estelí.
![]() Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
