Biología reproductiva del guapote pinto Parachromis managuensis (¨Gunter 1867¨) en Caño Negro - Humedales de Mahogany, El Rama, Nicaragua
Reproductive biology of the pinto guapote Parachromis managuensis (“Gunter 1867”̈) in Caño Negro - Mahogany Wetlands, El Rama, Nicaragua
Nestor Joel Gonzalez Aleman
Bluefields Indian & Caribbean University (BICU), Nicaragua
https://orcid.org/0000-0002-5006-4964
ngonzalezaleman@yahoo.es
Izayana Adelina Marenco Vivas
Facultad de Recursos Naturales y del Medio Ambiente (FARENA), Escuela de Biología Marina. Bluefields, Nicaragua
izayana1@hotmail.com
Oliver Orlando Solano Briton
Facultad de Recursos Naturales y del Medio Ambiente (FARENA), Escuela de Biología Marina. Bluefields, Nicaragua
cornbritton@gmail.com
RECIBIDO
27/06/2024
ACEPTADO
21/01/2025
RESUMEN
Son muy pocos los estudios de biología reproductiva de las especies icticas de importancia comercial en Nicaragua. Es por eso que, el interés principal de esta investigación es estudiar los aspectos relacionados con la biología reproductiva del guapote pinto (Parachromis managuensis) en el Parque Ecológico Municipal Humedales de Mahogany. Se recolectaron datos a partir de 122 ejemplares capturados en la zona de estudio durante un año, de los cuales se analizaron 26 gónadas de hembras maduras (EMIII), para finalmente corroborar si la especie presenta un único desove o múltiples desoves. Se encontró que la relación Hembra y Macho (H:M) promedio fue de 1H: 0.6M, siendo la longitud total promedio de esta muestra de 19.7 cm y 152.11 g de peso. En general, los machos alcanzaron mayores tamaños y pesos en comparación con las hembras. La Fecundidad absoluta (FA) fue de 2468 ovocitos, mientras que la fecundidad promedio (Fx) fue de 2450 ovocitos con diámetro promedio de 1.86 (+/- 0.10 mm): con un límite de confianza del 95%. De la relación entre el peso W y longitud furcal LF (W=0.39*LF1.96), el modelo potencial explica el 84% de la variabilidad del peso, presentando un crecimiento alométrico negativo. La talla de madurez sexual del 50% de la población (L50%M) fue de 12.2 cm en hembras y de 17.8 cm en machos. Se identificó que la temporada reproductiva ocurre en mayo, julio y septiembre, con un índice gonadosomático (IGS) máximo de 4.3 en julio. Además, se determinó que el número de ovocitos aumenta con el tamaño de la hembra, estimándose un incremento de 166 ovocitos por cada centímetro adicional de longitud. Se recomienda la protección de esta especie mediante la disminución de la pesca en las áreas de desove, durante la época reproductiva.
PALABRAS CLAVES
Edad; fecundidad; índice gonadosomático; reproducción; guapote pinto.
ABSTRACT
There are very few studies of reproductive biology of fish species of commercial importance in Nicaragua. That is why the main interest of this research is to study the aspects related to the reproductive biology of the guapote pinto (Parachromis managuensis) in the Mahogany Wetlands Municipal Ecological Park. Data were collected from 122 specimens captured in the study area for one year, of which 26 gonads of mature females (EMIII) were analyzed, to finally corroborate whether the species presents a single spawning or multiple spawning. It was found that the average Female and Male (F:M) ratio was 1H: 0.6M, with the average total length of this sample being 19.7 cm and 152.11 g of weight. In general, males reached larger sizes and weights compared to females. Absolute fertility (AF) was 2468 oocytes, while average fertility (Fx) was 2450 oocytes with an average diameter of 1.86 (+/- 0.10 mm): with a 95% confidence limit. The relationship between weight W and furcal length LF (W=0.39*LF1.96), the potential model explains 84% of the variability in weight, presenting a negative allometric growth. The sexual maturity height of 50% of the population (L50%M) was 12.2 cm in females and 17.8 cm in males. The breeding season was identified to occur in May, July, and September, with a maximum gonadosomatic index (IGS) of 4.3 in July. In addition, it was determined that the number of oocytes increases with the size of the female, estimating an increase of 166 oocytes for each additional centimeter of length. The protection of this species is recommended by reducing fishing in the spawning areas, during the reproductive season.
KEYWORDS
Age; fecundity; gonadosomatic index; reproduction; Guapote pinto.
INTRODUCCIÓN
El Río Caño Negro se caracteriza por poseer asociados a lo largo de su extensión un sistema de humedales de agua dulce bastante diverso, el cual le pertenece al sistema de humedales de Mahogany (Castrillo, 2000; Castrillo et al., 2000).
La extensión total del área es de 278 km2 y sus límites están definidos por las comunidades de Boca de Mahogany, Belén, Sisi, Magnolia y el Paraíso (Castrillo et al., 2000). El Consejo Municipal del Rama en el uso de las facultades que le confiere la Constitución Política de Nicaragua, ordenó la creación del “Parque Municipal Humedales de Mahogany”, todo esto bajo la ordenanza # 5 del 12 de junio del año 2000.
El guapote pinto, también conocido como guapote tigre (Parachromis managüense) es uno de los grandes cíclidos piscívoros de América Central (Bussing, 1998), con distribución natural desde Honduras hasta la zona Norte de Costa Rica (Bussing, 1998; Villa, 1982). Debido a su calidad gastronómica es un pez muy apreciado en la pesquería artesanal fluvial de Costa Rica y en la pesquería del Lago de Nicaragua (Vincenzi & Camacho., 1974), con pesos máximos de 1-2 Kg (Astorqui, 1976). Dentro de las especies nativas la familia Cichlidae constituyen el grupo más diversificado y numeroso (Günther, 2001; Gunther & Boza, 1994).
Una de las problemáticas que enfrenta la especie es la sobrepesca que se da en la época seca, no existe control sobre esta actividad en el Parque Ecológico. Es por eso que, es de vital importancia conocer las características biológicas para el manejo y gestión de los recursos pesqueros (Froese, 2006). Así mismo, conocer las estrategias reproductivas de la especie (Vazzoler, 1996) es de vital importancia para planificar la gestión sostenible del recurso y minimizar los impactos causados por la pesca (Favero et al., 2010).
El guapote pinto (Parachromis managüense), anteriormente citados en otras bibliografías como Cichlasoma managüense, es un pez cíclido carnívoro de América Central (Ángulo et al., 2023; Bussing, 1998). Este está siendo investigado para establecer su potencial en la acuicultura comercial (Günther, 2001). Habita los lagos, con preferencia en aguas turbias y fondos lodosos, especialmente en aquellos con alto grado de eutrofización (Conkel, 1993). Se encuentra en arroyos y estanques con detritus y fondos de arena (Page & Burr M, 1991). Comúnmente se encuentra en lagos de inundación cálidos con concentraciones de oxígeno bajas (Nassar & Gunther, 1992).
En la acuacultura el guapote pinto es utilizado como una alternativa para contribuir con la seguridad agroalimentaria (Jácome et al., 2019) y ha venido siendo utilizado como controlador de la reproducción indeseada en estanques de cultivo extensivo de tilapia (Teichert-Coddington, 1994). Se ha investigado la producción de juveniles del guapote tigre (Cabrera & Mora, 1992; Günther et al., 1992; Gunther & Boza, 1994), así como el efecto de la densidad sobre su cultivo ya sea en acuarios (Günther, 1996) o a nivel semi comercial en jaulas (Umaña, 1994). La fecundidad total de este pez es entre 904 a 10,496 huevecillos y con un promedio de 3,158 huevecillos/hembra (Agasen et al., 2006).
Parachromis managuensis (Gunter, 1868)
Descripción general de la especie Parachromis managuensis según (Bussing, 1998; Fischer et al., 1995; Villa, 1982):
Esta especie se caracteriza por su boca grande, mandíbula inferior saliente, cuerpo y aletas manchadas de negro. Otros detalles importantes son el lóbulo en el ángulo inferior del preopérculo y el mayor número de branquiespinas. La coloración general varia de un verde dorado a morado. El lomo es verde-musgo, los costados dorados con un matiz morado y el vientre amarillento. Además del patrón de manchas negras circulares sobre el cuerpo, se distingue a menudo una banda negra más o menos continua entre el ojo y la cola y otra entre el ojo y el ángulo inferior del opérculo. Las aletas dorsal y anal son de color azul o turquesa con motas negras sobrepuestas. La cola es parda con matices azules en la base. El iris del ojo es rojo.
Taxonomía
Orden: Perciformes
Familia: Cichlidae
Subfamilia: Cichlasomatinae
Clase: Actinopterygii
Género: Parachromis
Especie: Parachromis managuensis

Figura 1. Fotografía de Parachromis managuensis (González, 2007).
Este guapote es bastante común entre las malezas en el litoral del lago de Nicaragua (Bussing, 1998), es de aguas estancadas entre 0 y 45 m de altura, es piscívoro y alcanza por lo menos 220 mm (Villa, 1982). Según (Bussing, 1998; Fischer et al., 1995; Villa, 1982) estos peces viven en escondites entre troncos y piedras en zonas litorales a temperaturas entre 25 y 36° C.
Por ello, el objetivo principal de la investigación es estudiar los aspectos relacionados con la biología reproductiva del guapote pinto (Parachromis managuensis) en el Parque Ecológico Municipal Humedales de Mahogany del municipio del Rama, Nicaragua.
MATERIALES Y MÉTODOS
Descripción del área de estudio
El área de estudio está ubicada en el Parque Ecológico Municipal Humedales de Mahogany, en el río Caño Negro, el cual es uno de los subsidiarios principales del Río Mahogany, el cual forma parte de la cuenca del Río Escondido. El sitio de muestreo se localiza en un área del río Caño Negro conocido como la poza (11°59'49.62"N, 84° 2'38.87"O). En el sitio se estableció un tramo de 100 metros de longitud, con una profundidad media de 2 metros y una anchura promedio de 6 metros.
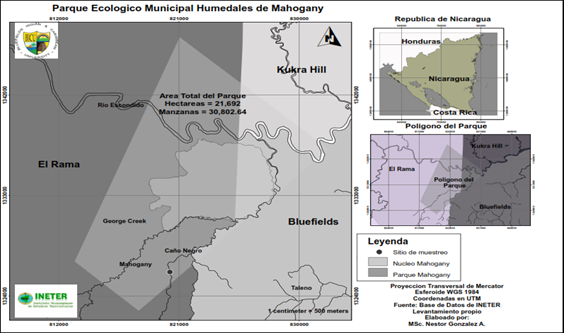
Figura. 2. Mapa del área de estudio, Río Caño Negro, Nicaragua.
Etapas de investigación
Etapa 1. Trabajo de campo y laboratorio: Para las capturas se utilizó una red de cerco de 10 metros de largo por dos metros de ancho y una luz maya de 3 pulgadas, También se utilizó una atarraya de 5 pies. In situ, a cada individuo se le tomó la longitud estándar (LS) y longitud total (LT) al milímetro más cercano con un Ictiómetro, y el peso total y eviscerado (W) al gramo más cercano con una balanza de campo con capacidad de 1500 g (±0.01g), colocándose en bolsas plásticas codificadas y conservadas en neveras de poliuretano. Las muestras de escamas y gónadas fueron conservadas en alcohol al 70% y formalina al 30% respectivamente.
El sexo y la fase de madurez se determinó mediante observación de las características macroscópicas de los ovarios y testículos (Vazzoler, 1996), la madurez de los ovarios (Fontoura et al., 2009), porcentaje de los ovocitos (Oliva et al., 1986) y el desarrollo de las gónadas (Froese, 2006; Oliva-Paterna et al., 2007), se modificó y adaptó la tabla de criterios de (Caballero-Chávez, 2011; Caballero-Chavez et al., 1995). El diámetro de los ovocitos se hizo a través del software ImagenJ (Collins, 2007). Para determinar las clases de edad se analizaron escamas del flanco izquierdo entre el inicio de la aleta dorsal y la línea lateral (Bagenal & Tesch, 1978).
Etapa 2. Análisis estadísticos: se realizó el test chi cuadrado χ2 (χ2 = ((O-E)2/E)*2) con un nivel de significación del 5% (0,05), si χ2 > 3,84 si existe diferencia significativa en la proporción 1:1 (Vazzoler, 1996). La relación entre el peso de la gónada y el peso del organismo, es decir el índice gonadosomático (IGS) (IGS = (Pg/Pt)*100), se obtuvo a través del análisis de gónadas (Wootton, 1990). La fecundidad absoluta (FA) (FA = ñ*A/a*P/G) se hizo mediante el método volumétrico (Caballero-Chávez, 2011), la fecundidad promedio (Fx) (Fx = Σa*LF) se determinó como la media de los valores resultantes del conteo de huevos (Shoesmith, 1990).
Se estimó la relación entre la longitud furcal (LF) y el peso (W) de manera mensual con la formula (W = a * LF b), la cual es una regresión potencial que relaciona la talla con el volumen (Le Cren, 1951). Se estimó la talla de primera madurez (L 50%M) (P = 1/1 + exp (-r(LT - Lm)), el cual es un modelo sigmoidal (King, 1995). Finalmente, con los valores obtenidos de la fecundidad (F) (F = a * LF b) se determinó la relación que existe entre ésta y la longitud furcal (LF), el cual es un modelo potencial (Gerking, 1978).
Etapa 3. Uso de software: Para el cálculo del diámetro de ovocitos se utilizó el software ImagenJ (Collins, 2007). El Software reconoce a los ovocitos como partículas y proporcionó información del diámetro, volumen, radio y número total de ovocitos en la imagen.
RESULTADOS Y DISCUSIÓN
Población: De esta población se analizó un total de 122 individuo en el Centro de Investigaciones Acuática y Biológica (CIAB), 75 fueron hembras, 45 machos y 2 indiferenciados (sin ovarios ni testículos). La clase de edad 4+ presentó un 40% de las capturas totales y 44.3% de la población muestreada se encontró ya desovado, es decir en periodo de quiescencia o reposo.
Tabla 1: numero de ejemplares segun las clases de edad (CE) y estudio de maduración (EM) en Parachromis managuensis
| Lugar | Especie | Clases de Edad (CE) | Número de ejemplares | Estadio de Maduración (EM) | Longitud promedio por Clase de Edad (cm) | Peso Total promedio por Clase de Edad (g) | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| Ind* | I | II | III | IV | ||||||
| Caño Negro (Parque Ecológico Municipal Humedales de Mahogany) | Parachromis managuensis | 2+ | 18 | 1 | 9 | 8 | 13.60 | 78.27 | ||
| 3+ | 39 | 1 | 14 | 9 | 15 | 18.40 | 110.88 | |||
| 4+ | 49 | 15 | 11 | 23 | 21.30 | 166.12 | ||||
| 5+ | 9 | 2 | 3 | 4 | 23.90 | 239.45 | ||||
| 6+ | 4 | 2 | 2 | 26.30 | 307.93 | |||||
| 7+ | 3 | 1 | 2 | 27.80 | 415.8 | |||||
| * Caracteres visuales "Vazzoler, 1996". I= Inmaduras, II= En proceso de Maduración, III= Maduras y IV= Post-reproductora (desovado o quiescencia). | ||||||||||
Para los pobladores vecinos al Parque Ecológico, esta especie es la más abundante y representa una fuente importante para la alimentación (Castrillo, 2000), es la especie de mayor abundancia y equitatividad (González-Alemán, 2006) y tiene una gran demanda en los mercados locales (Arauz, 2001). Los pobladores han reportado una disminución de tallas grandes de la población, el uso de pesticidas y aparición de especies exóticas como la tilapia (Cichlidae) y el pleco (Loricariidae) recientemente (Betts et al., 2020).
Sexo: La proporción de sexo durante el estudio en Parachromis managuensis mostró una leve dominancia de hembras en relación a los machos (1H: 0,6M), presentando diferencias significativas (χ2 < 3.84 y p > 0.05) únicamente en el mes de agosto del 2019 a favor de los machos, enero y marzo a favor de las hembras en el 2020.
Tabla 2. Proporción sexual en Parachromis managuensis y χ2 observado por mes.
| Especie | Mes | Hembra | Macho | Total | % Hembras | % Machos | Esperados | χ2 | Proporción H:M |
|---|---|---|---|---|---|---|---|---|---|
| Parachromis managuensis |
Agosto | 2 | 14 | 16 | 12.50 | 87.50 | 8 | 9.00* | 1 : 7 |
| Septiembre | 10 | 7 | 17 | 58.82 | 41.18 | 8.5 | 0.53 | 1 : 0.7 | |
| Octubre | 6 | 6 | 12 | 50.00 | 50.00 | 6 | 0.00 | 1 : 1 | |
| Enero | 17 | 5 | 22 | 77.27 | 22.73 | 11 | 6.55* | 1 : 0.3 | |
| Marzo | 15 | 5 | 20 | 75 | 25 | 10 | 5.00* | 1 : 0.3 | |
| Mayo | 10 | 3 | 13 | 76.92 | 23.08 | 6.5 | 3.77 | 1 : 0.3 | |
| Julio | 8 | 2 | 10 | 80.00 | 20.00 | 5 | 3.60 | 1 : 0.3 | |
| Septiembre | 7 | 3 | 10 | 70.00 | 30.00 | 5 | 1.60 | 1 : 0.4 | |
| Test χ2 con un nivel de significación del 5%, si χ2 > 3,84 existe diferencia significativa en la proporción 1:1 | |||||||||
La mayoría de los estudios realizados en la región son trabajos descriptivos región (Arauz, 2001; Brenes & Castillo, 1999; Cotto S., 2001; DIPAL & CIRH, 1997; González-Aleman et al., 2018), son pocos los trabajos que se refieren a aspectos biológicos de las especies (Camacho & Gadea, 2005). La relación hembra y macho (proporción H:M) proporciona información sobre los periodos o épocas de apareamiento y desove de muchas especies de importancia comercial, en especial para la piscicultura (Froese, 2006; Oliva et al., 1986; Vazzoler, 1996).
Indice Gonadosomático o de madurez sexual (IGS): La mayor parte de las muestras estuvo conformada por individuos en estado de reposo o quiescencia. El índice de madures sexual alcanzo su mayor valor en los meses de mayo, julio y septiembre, encontrándose diferencias estadísticas significativas (p<0.05).
Los meses en que se observó diferencias significativas en la relación H:M, fueron lluviosos, para (Tresierra & Culquichicón, 1993; Vazzoler, 1996) estos meses son muy importantes para la planificación pesquera. La mayor cantidad de hembras y machos maduros (18 de 26 y 5 de 6 respectivamente) se observaron en mayo y julio, estos datos coinciden con lo reportado por (Angel et al., 2014), en esta época toda el área adyacente se inunda y forma lo que conocemos como los llanos de inundación de Caño Negro y Mahogany (Castrillo, 2000).
Por lo tanto, la época de reproducción según el Indice Gonadosomático (IGS) se da en la estación lluviosa favorecido por las condiciones hidrográficas de la zona, lo cual favorece la estrategia reproductiva utilizada por Parachromis managuensis con periodos de desove muy cortos (Pérez‐Vega et al., 2006).
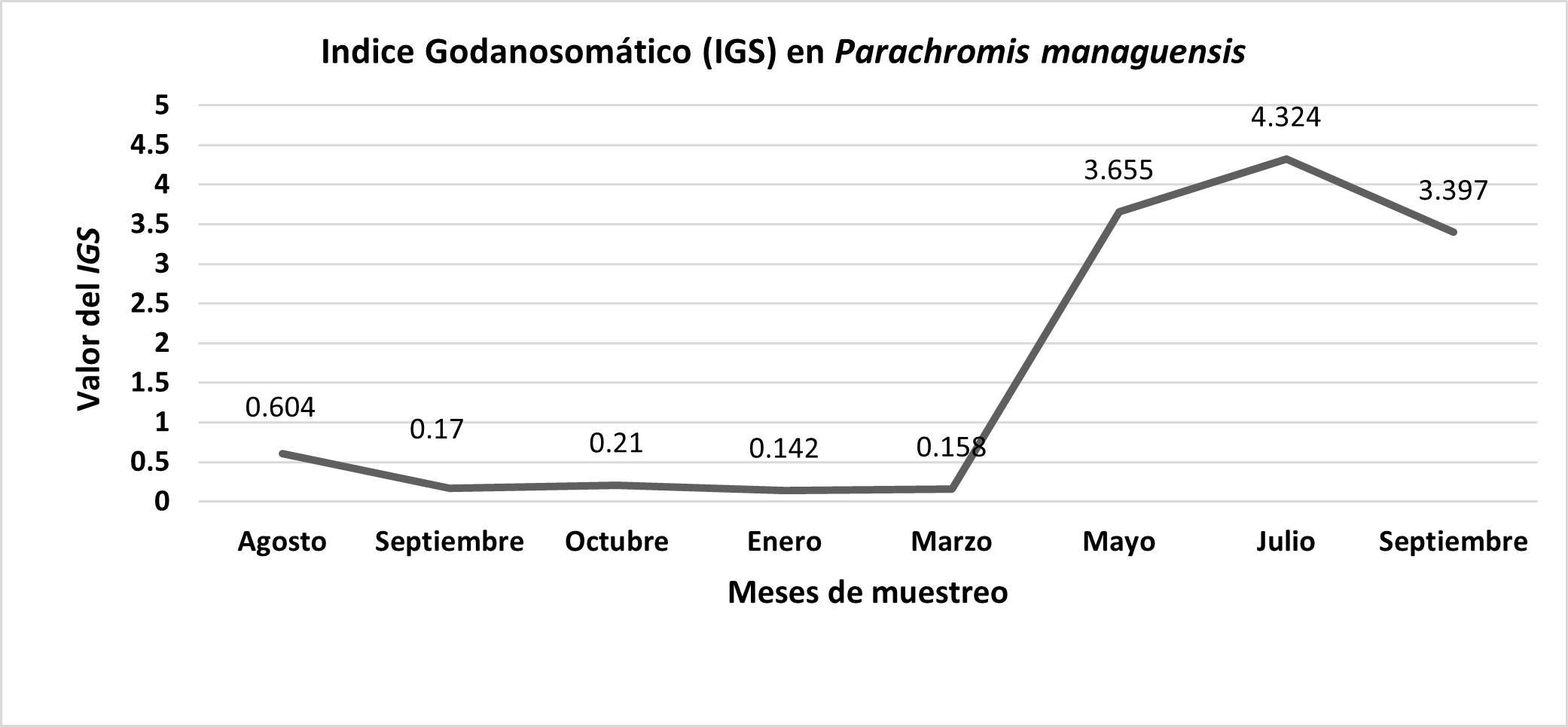
Figura. 3. Índice de madure sexual en la muestra de la población de Parachromis managuensis.
Fecundidad: Para determinar la fecundidad promedio y absoluta se analizaron un total de 26 ovario de hembra, todas maduras (EMIII). La hembra con mayor número de ovocito fue de 3420 huevos (22.1 cm LT y 170.1 g W) y la de menor fue de 1092 huevos (12.7 cm LT y 75.5 g W). La Fecundidad absoluta (FA) obtenida promediando los valores del conteo de ovocitos fue de 2468 y la fecundidad promedio (Fx) utilizando el método de Shoesmith (1990) fue de 2450 ovocitos.
Los datos de fecundidad reportado están por debajo de lo hallado por (Agasen et al., 2006; Angel et al., 2014), quienes reportan que la fecundidad total de este pez es entre 904 a 10496 huevecillos y con un promedio de 3158 huevecillos/hembra.
Relación longitud LT- peso W: El modelo resultante explica el 84% de la relación entre ambas variables. En términos generales, la población analizada presenta un crecimiento alométrico negativo, lo que indica que la longitud aumenta en mayor proporción que el peso.
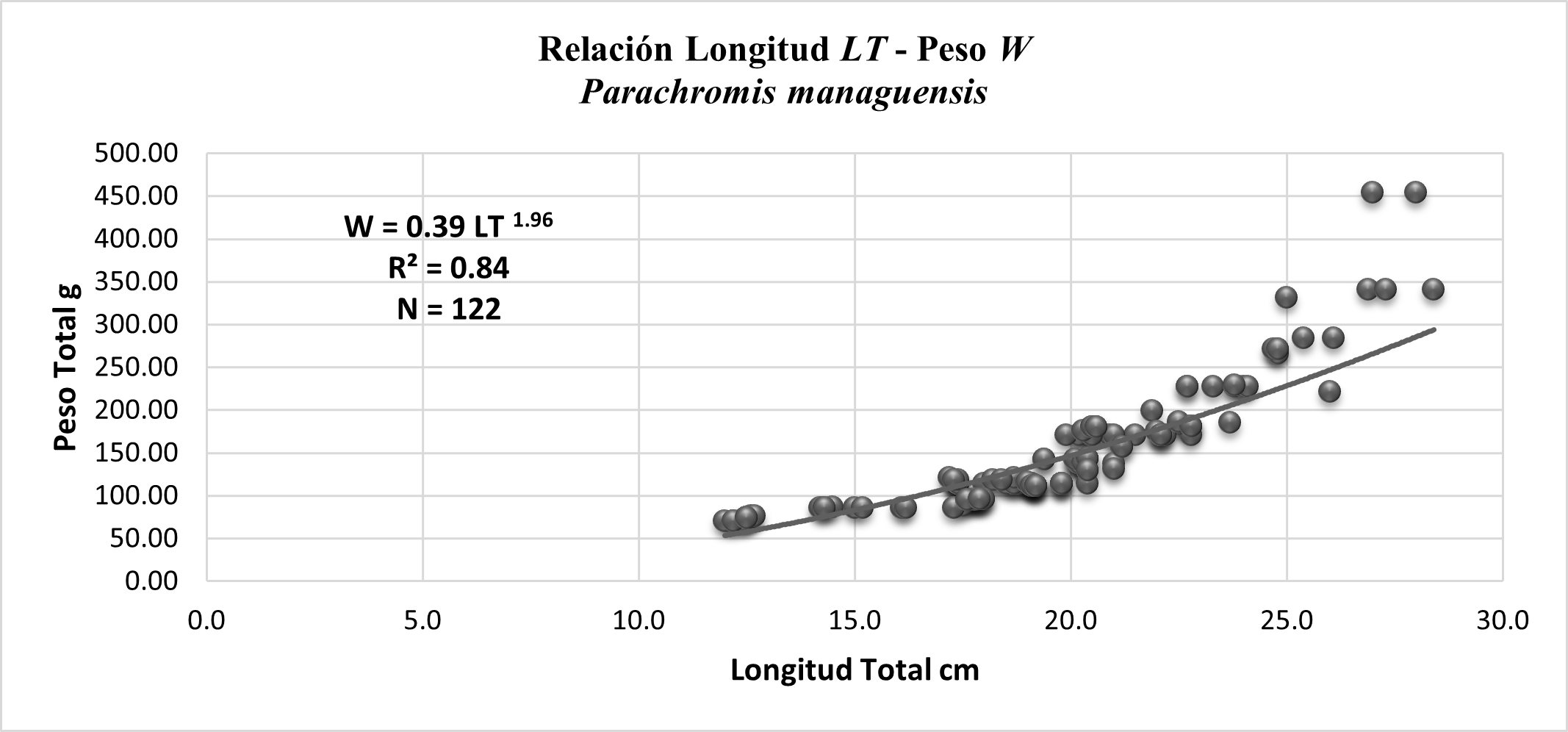
Figura. 4. Modelo ajustado de la relación entre la Longitud (LT) y el peso (W) en la población de Parachromis managuensis.
Los estudios sobre esta especie indican que puede llegar alcanzar una longitud máxima de 55 cm y 1580 g de peso (Bussing, 1998), ninguno de los ejemplares capturados en esta investigación superó los 30 cm de longitud.
Los machos son los que presentan mejor coeficiente de crecimiento en relación a LT-W total estimados, con un intervalo de confianza del 95%, según (Olaya-Nieto et al., 2008) el intervalo de crecimiento se encentra dentro del rango 2.34 – 3.13 para algunas especies de la familia Cichlidae. La muestra de esta población presento mayor crecimiento en longitud que en peso, coincidiendo con lo reportado por (Günther, 1996, 2001; Umaña, 1994) en juveniles de Parachromis managuensis.
Talla de la Primera madurez (L 50%M): Se analizó un total de 26 hembras en estado maduro (EM III) y 4 machos maduros (EM III). La talla a la cual el 50% de las hembras alcanzan la madurez fue de 12.2 cm perteneciente a la clase de edad 2+, en los machos el tamaño fue de 17.8 cm de la clase de edad 3+.
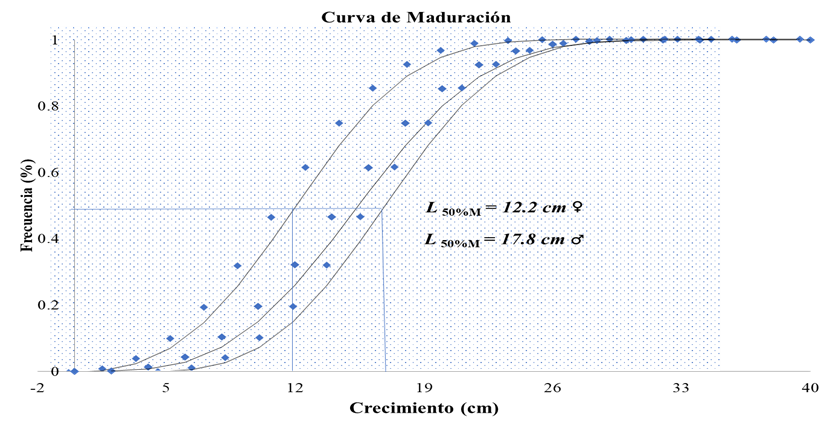
Figura. 5. Talla media de Madurez sexual para hembras (♀) y machos (♂) de Parachromis managuensis.
Los machos son los que crecen más rápido (Günther, 1996; Nassar & Gunther, 1992), a como se observó durante los análisis de gónadas de los ejemplares capturados. Por su rápido crecimiento y agresividad, son utilizados como controladores de la reproducción indeseada en estanques de cultivo de tilapia (Ramos, 2004; Teichert-Coddington, 1994).
Relación entre longitud furcal LF y fecundidad absoluta FA: El modelo de la relación entre LF y FA nos explica un 66% de la relación entre la fecundidad y la longitud del pez, se observa que, a mayor tamaño, mayor número de ovocito, por cada centímetro que incrementa en tamaño la hembra representan 166 ovocitos potenciales.
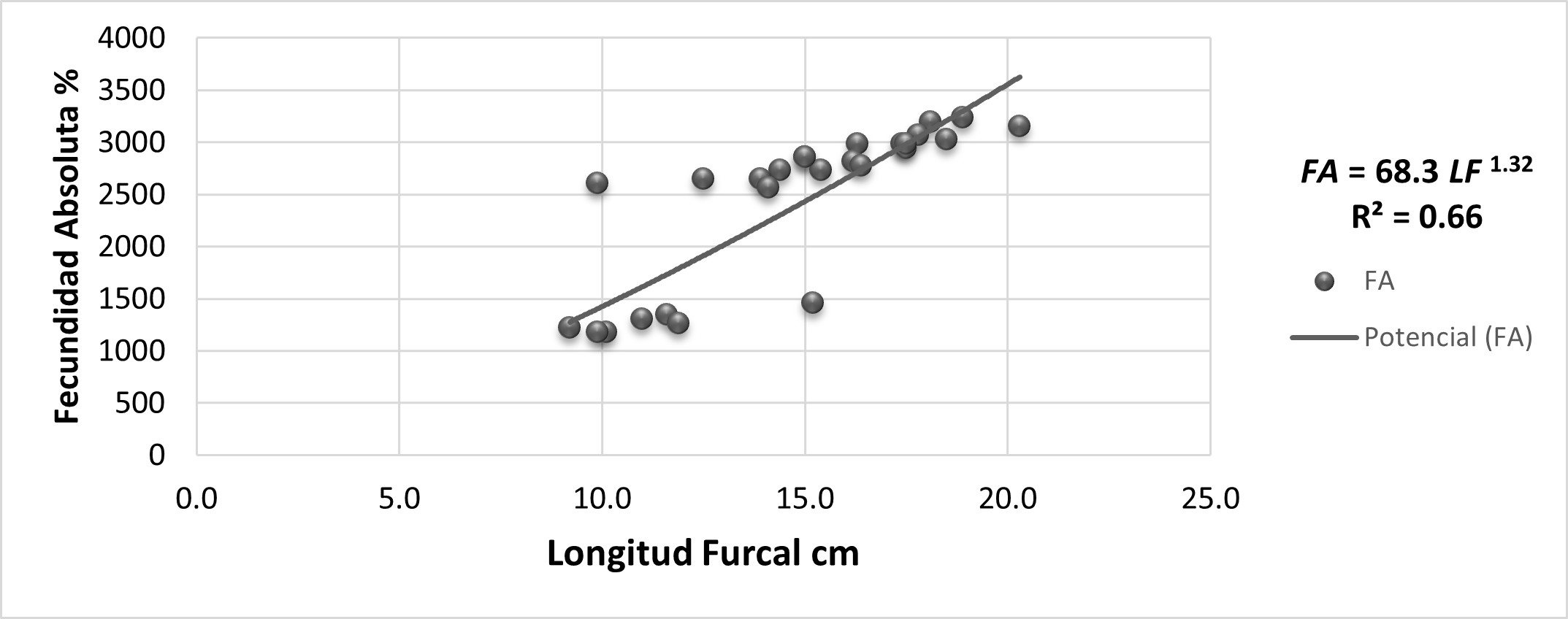
Figura. 6. Modelo ajustado de la relación entre la Longitud Furcal (LF) y fecundidad absoluta (FA).
La talla de maduración encontrados en las hembras fueron menores a los encontrados por (Dos Santos, 2019; Resende et al., 2020) en algunas poblaciones introducidas en Brazil y también a las reportadas en su prima Parachromis dovii en el Lago Hule de Costa Rica (Tabash B & Guadamuz S, 2000).
Diámetro de los ovocitos: El diámetro (Ø) promedio de huevos para las muestras analizada fue de 1.86 +/- 0.10 mm: con un límite de confianza de 95%. Durante el periodo reproductor de Parachromis managuensis, más del 95% de la muestra se encontró con una distribución unimodal de diámetros oocitarios.

Figura. 7. Fotografía de la muestra de gónadas para realizar el conteo y medición del diámetro de ovocitos para Parachromis managuensis.
Mas del 86% de la población muestreada fueron juveniles que no superaban los 30 cm de longitud, esto puede condicionar la fecundidad de las hembras, ya que a mayor tamaño se observa mayor número de huevos (Froese, 2006). La evidencia encontrada durante el análisis macroscópico de ovarios muestran que las hembras no realizan múltiples puestas, presentando una distribución unimodal de ovocitos traslucidos maduros, aunque (Angel et al., 2014; Gunther & Boza, 1994; Pérez‐Vega et al., 2006) aseguran que puede reproducirse hasta 5 veces en 7 meses aproximadamente.
CONCLUSIONES
La proporción sexual fue de (1H: 0,6M), presentando diferencias significativas (χ2 < 3,84 y p > 0,05) en agoto del 2019 en los machos y en las hembras en los meses de enero y marzo del 2020. El modelo que se obtuvo de la relación entre la longitud y el peso (W = 0.39 LT 1.96) explica el 84% de la relación entre las variables, presentando un crecimiento alométrico negativo.
Los análisis del Índice Gonadosomá tico (IGS) nos indicó que Parachromis managuensis se reproduce en los meses de la estación lluviosa (mayo, julio, septiembre). El peso de las gónadas solo representó el 4% del peso del pez.
La fecundidad absoluta (FA) fue de 2,468 ovocitos/hembras y la fecundidad promedio (Fx) fue de 2,450. El diámetro (Ø) promedio de huevos para las muestras analizadas fue de 1.86 +/- 0.10 mm: L.C 95%. La Talla de Talla de la Primera madurez (L 50%M) encontrada fue de 12.2 en hembras y 17.8 en machos.
El modelo de la relación entre la longitud furcal (LF) y la fecundidad absoluta (FA) explica el 66% de la relación entre estas variables (FA = 68.3 LF 1.32 y R2 = 0.66). Por cada centímetro que incremente en tamaño la hembra representan 166 ovocitos/hembras potencialmente.
De acuerdo a los resultados obtenidos en cuanto a su densidad, Fecundidad y el factor de condición, se considera que la especie tiene altas probabilidades de reproducirse bajo sistemas controlados, ya que el ecosistema presta las condiciones necesarias para su reproducción en la acuicultura.
REFERENCIAS BIBLIOGRÁFICAS
Agasen, E. V. E. V., Clemente, J. P. J. P., Rosana, M. R. M. R., & Kawit, N. S. N. S. (2006). Biological investigation of Jaguar guapote Parachromis managuensis (Gunther) in Taal Lake, Philippines. JESAM, 9(2), 20–30.
Angel, L. E. A., Huerta, E. E., & Brito, R. (2014). Ficha técnica mojarra pinta Parachromis managuensis.
Angulo, A., Betts, J. T., González-Alemán, N. J., Castañeda, E., Den Berghe, E. Van, Elías, D. J., McMahan, C. D., & Matamoros, W. A. (2023). Continental fishes of Nicaragua: diversity, distribution and conservation status; with an annotated and illustrated checklist of species and an identification guide to families. In Zootaxa (Vol. 5376, Issue 1). https://doi.org/10.11646/zootaxa.5376.1.1
Arauz, J. (2001). La caracterización de las especies de peces de valor comercial de la Bahía de Bluefields y su alrededor. DIPAL, 2001.
Astorqui, I. (1976). Peces de la cuenca de los grandes lagos de Nicaragua. Biological Sciences, 19, 197–249.
Bagenal, T., & Tesch, F. W. (1978). Age and Growth. In: Bagenal, T. (Ed.), Methods for assessment of fish production in freshwaters. Blackwell Scientific Publications, London., 101–136.
Betts, J. T., Mendoza Espinoza, J. F., Dans, A. J., Jordan, C. A., Mayer, J. L., & Urquhart, G. R. (2020). Fishing with Pesticides Affects River Fisheries and Community Health in the Indio Maíz Biological Reserve, Nicaragua. Sustainability, 12(23), 10152.
Brenes, & Castillo, E. (1999). Hidrografía de la bahía de Bluefields. In Proyecto DIPAL II, Bluefields, Nicaragua.
Bussing, W. A. (1998). Freshwater fishes of Costa Rica. Peces de las Aguas Continentales de Costa Rica. San Jose, Costa Rica, 496 p. (Vol. 46). Editorial Universidad de Costa Rica.
Caballero-Chávez, V. (2011). Reproducción y fecundidad del robalo blanco (Centropomus undecimalis) en el suroeste de Campeche. Ciencia Pesquera, 19(1), 35–46.
Caballero-Chavez, V., L.F. Peña-Durán, J.F. Echavarría-Vera, O. Jiménez-Morales, & J.A. Zamora. (1995). Contribución al conocimiento de la biología del robalo blanco (Centropomus undecimalis Bloch, 1792). Informe de Investigación (documento interno). CRIP - Ciudad del Carmen. Instituto Nacional de la Pesca. México. 64p.
Cabrera, P., & Mora, J. (1992). Fecundidad de Cichlasoma dovii (Pisces: Cichlidae) en el embalse Arenal, Guanacaste, Costa Rica. Revista de Biologia Tropicala Tropical, 40(3), 345–346.
Camacho, J. J., & Gadea, V. (2005). Estudio técnico científico del róbalo en Río San Juan y el Gran Lago de Nicaragua.
Castrillo, M. (2000). Plan de Manejo de los Humedales de Mahogany: primera propuesta de zonificación. Revista Trimestral Humedales de la RAAS, Año 2, No. 3. PROCODEFOR. Bluefields, RAAS, Nicaragua.
Castrillo, M., Ramos, Z., & Karremans, J. (2000). Ficha Técnica Ramsar: Sistema de Humedales de la Bahía de Bluefields. Bluefields, Nicaragua, 28 de Julio 2000.
Collins, T. J. (2007). ImageJ for microscopy. Imaging Frontiers. July, 2007. Biotechniques, 43(1), 25–30.
Conkel, D. (1993). Cichlids of North & Central America. Neptune City, NJ: TFH Publications.TFH Publications Neptune City, NJ.
Cotto S., A. (2001). Guía de identificación de peces marinos del mar Caribe de Nicaragua. Proyecto para el Desarrollo Integral de la Pesca Artesanal en la Región Autónoma del Atlántico Sur, Nicaragua (DIPAL). Proyecto DIPAL II, 2001.
DIPAL, & CIRH. (1997). Plan de Manejo Integral para los recursos Hidrobiológicos de la Cuenca de Laguna de Perlas y la Desembocadura del Río Grande. Laguna de Perlas, Nicaragua. 39 pp.
Dos Santos, D. N. (2019). Biología reprodutiva e alimentar do peixe-jaguar, Parachromis managuensis (Perciformes: Cichlidae) no semiárido pernambucano.
Favero, J. M. del, Pompeu, P. dos S., Valladares, A. C. P., Menegassi Del Favero, J., Dos, P., Pompeu, S., Prado Valladares, A. C., Favero, J. M. del, Pompeu, P. dos S., & Valladares, A. C. P. (2010). Aspectos reprodutivos de duas espécies de ciclídeos na Reserva de Desenvolvimento Sustentável Amanã, Amazonas, Brasil. Revista Brasileira de Zoociências, 12(2), 7–14.
Fischer, W., Krupp, F., Schneider, W., Sommer, C., Carpenter, K. E., & Niem, V. H. (1995). Guia FAO para la identificacion de Especies para los fines de la pesca. Pacifico centro-oriental. Volumen II. Vertebrados - Parte 1. Roma, FAO. 1995. Vol. II: 647-1200 P.
Fontoura, N. F., Braun, A. S., & Milani, P. C. C. (2009). Estimating size at first maturity (L50) from Gonadossomatic Index (GSI) data. Neotropical Ichthyology, 7(2), 217–222.
Froese, R. (2006). Cube law, condition factor and weight-length relationships: History, meta-analysis and recommendations. Journal of Applied Ichthyology, 22(4), 241–253.
Gerking, A. (1978). Ecology of freshwater fish production.(B. S. Pubs. (ed.)).
González-Alemán, N. (2006). Ictiofauna del rio Mahogany y su afluente Caño Negro. Bluefields, Nicaragua. Marzo, 2006.
González-Aleman, N., Mairena-Valdivia, Á., & Webster-Logan, E. I. C.-R. O. (2018). Caracterización y Biometría de la Ictiofauna de la Laguna de Karata en la Región Autónoma de la Costa Caribe Norte (RACCN). Wani Revista Del Caribe Nicaragüense, 75, 18.
Günther, J. (1996). Crecimiento del guapote tigre, Cichlasoma managuense (Pisces: Cichlidae) bajo régimen de cultivo intensivo en estaques de tierra. Rev. Biol. Trop., 44(2), 813–818.
Günther, J. (2001). Efecto de la temperatura sobre el crecimiento del juveniles del Guapote Lagunero (Parachromis dovii). Escuela de Ciencias Biologicas, UNA, Costa Rica. Uniciencia, 18, 53–55.
Günther, J., Galvez-Hidalgo, N., Ulloa-Rojas, J., Coppoolse, J., & Verreth, J. (1992). The effect of feeding level on growth and survival of jaguar guapote (Cichlasoma managuense) larvae fed Artemia nauplii. Aquaculture, 107(4), 347–358.
Gunther, N. J., & Boza, A. J. (1994). Batch fertility and larval parameters of the jaguar cichlid (Cichlasoma managuense) spawned in laboratory. Uniciencia, 11(1–2), 37–41.
Jácome, J., Quezada Abad, C., Sánchez-Romero, O., Pérez, J. E., & Nirchio, M. (2019). Tilapia en Ecuador. Revista Peruana de Biología, 26(4), 543–550. https://doi.org/10.15381/rpb.v26i4.16343
King, M. (1995). Fisheries biology, assessment and management. Fishing News Books, Blackwell Science, Osney Mead, Oxford OX2 OEL, England.
Le Cren, E. D. (1951). The Length-Weight Relationship and Seasonal Cycle in Gonad Weight and Condition in the Perch ( Perca fluviatilis ). British Ecological Society, 20(2), 201–219.
Nassar, M. A., & Gunther, N. J. (1992). Growth Of Jaguar Cichlid (Cichlasoma Managuense) juveniles at different oxygen levels. Uniciencia, 9, 3–5.
Olaya-Nieto, C. W., Segura-Guevara, F. F., Tordecilla-Petro, G., & Appeldoorn, R. S. (2008). Biología básica del cocobolo (Aequidens pulcher Gill, 1858) en la Cienaga Grande de Lorica, Colombia. Lorica, Colombia. Septiembre 2008.
Oliva-Paterna, F. J., Miñano, P. A., Torralva, M., & Fernandez-Delgado, C. (2007). Estrategias reproductoras de Barbus graellsii y Chondrostoma miegii (Pisces , Cyprinidae) en el río Cinca (NE Península Ibérica). Zoologia Baetica, 18, 3–20.
Oliva, J. N., Carbajal, J. W., & Tresierra, A. (1986). Reproducción e histología de gónadas de peces. Univerdidad Nacional de Trujillo, Peru, 1986.
Page, L. M., & Burr M, B. (1991). A field guide to freshwater fishes: North America, north of Mexico. Houghton Mifflin Harcourt. Houghton Mifflin. file://catalog.hathitrust.org/Record/002498916
Pérez‐Vega, M. H., Uribe‐Aranzabal, M. C., García‐Lorenzana, M., Romero‐Ramírez, M. C., & Arredondo‐Figueroa, J. L. (2006). Description of the ovarian follicle growth of the neotropical cichlids Petenia splendida and Parachromis managuensis (Perciformes: Cichlidae). Journal of Applied Ichthyology, 22(6), 515–520.
Ramos, F. G. (2004). Analisis del Beneficio-Costo del Engorde de Tilapia con y sin Guapote en Zamorano.
Resende, A. G. A., França, E. J. de, Oliveira, C. D. L. de, & Santana, F. M. (2020). Maturity, growth and natural mortality rate of the introduced fish Parachromis managuensis (Perciformes: Cichlidae) in the semiarid region of Brazil. Acta Limnologica Brasiliensia, 32, 10. https://doi.org/10.1590/s2179-975x2820
Shoesmith, E. (1990). A comparison of methods for estimating mean fecundity. Journal of Fish Biology, 36(1), 73–84.
Tabash B, F. A., & Guadamuz S, E. (2000). A management plan for the sport fishery of Parachromis dovii (Pisces: Cichlidae)(Gunther 1864) in Hule lake, Costa Rica. Revista de Biología Tropical, 48(2–3), 473–485.
Teichert-Coddington, D. (1994). Development of production technologies for semi-intensive fishfarming during the past decade in Central America. Universidad Nacional, Heredia, Costa Rica. Investigación Acuícola (Acuacultura y Pesca) En Centroamérica. Universidad Nacional, Heredia, Costa Rica, 71–88.
Tresierra, A., & Culquichicón, Z. (1993). Biología pesquera. Editorial Libertad E.I.R.L.. Trujillo. Perú. 432 pp.
Umaña, R. (1994). Crecimiento del guapote tigre (Cichlasoma managuense, Günther 1869) en cultivo intensivo en jaulas a escala semiconercial. Tesis de Licenciatura, Universidad Nacional, Heredia, Costa Rica.
Vazzoler, A. E. A. de M. (1996). Biología da reproduçao de peixes Teleósteos: Teoría e práctica. In Maringá, Eduem: SBI.
Villa, J. (1982). Peces Nicaragüenses de agua dulce. Colección Cultural, Banco de América. Serie Geografía y Naturaleza número 3. Managua, Nicaragua. 1982.
Vincenzi, A., & Camacho., J. A. (1974). Peces lacustres y fluviales de Costa Rica, guía práctica del pescador. Casa Gráfica Ltda, San José. 69 p.
Wootton, R. J. (1990). Ecology of Teleosteos Fishes. Chapman & Hall. London., 404.© 2024 Revista Científica Estelí.
![]() Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
