Año 2019 | Vol.5 35 – 43 |
|---|
Evaluación de las concentraciones de mercurio total en Tilapias (Oreochromis sp.) y Guapotes (Parachromis managüensis) del río Tipitapa.
Assessment of total mercury concentrations in Tilapias (Oreochromis sp.) and Guapotes (Parachromis managüensis) from Tipitapa river.
Xaviera Méndez Doña1 & Bertha Fierro Correa1
1Laboratorio de Mercurio ambiental, Centro para la Investigación en Recursos Acuáticos de Nicaragua, Universidad Nacional Autónoma de Nicaragua, Managua (CIRA/UNAN-Managua).
RESUMEN
El río Tipitapa es la única conexión superficial no continua que une a los dos grandes lagos de Nicaragua, el Xolotlán y el Cocibolca. Este escenario intermitente ha causado preocupación porque hay muchos estudios que muestran que el Xolotlán contiene altos niveles de mercurio total (metal altamente tóxico) en sedimento y peces. El objetivo de este estudio fue evaluar los niveles de mercurio total (HgT) en dos especies de peces (tilapias y guapotes) consumidas por la población del sector del río Tipitapa para estimar los riesgos a la salud humana. Las 59 muestras de peces se obtuvieron mediante la compra directa a los pescadores de la zona El Diablillo y San Juan de la Plywood (tilapias n=31 y guapotes n=28). Los análisis de HgT en las muestras de músculo fueron realizados por espectrometría de absorción atómica con generación de vapor frío. Las concentraciones de HgT en peso húmedo en los guapotes variaron de 0,018 a 0,176 mg.kg-1 y en las tilapias de entre menor al límite de detección (<ld= 0,005 mg.kg-1) a 0,007 mg.kg-1. Todos los resultados obtenidos estuvieron por debajo del límite máximo recomendado por la Organización Mundial de la Salud para consumo humano (0,5 mg.kg-1). No se detectaron correlaciones de Spearman significativas entre la longitud (p=0,324) y el peso (p=0,243) versus la concentración de HgT en tilapias; ni para los guapotes (p=0,261 y p=0,079, respectivamente). El contenido de HgT encontrado en los peces piscívoros (guapotes) fue significativamente más alto (p=0,000) que el detectado en los peces omnívoros (tilapias). Estos hallazgos implican que la tilapia del río Tipitapa es una especie de pez inocua en términos de mercurio para el consumo de las poblaciones humanas que habitan cerca del río además de barata, seguida por el guapote.
Palabras clave: peces piscívoros, peces omnívoros, río Tipitapa, mercurio.
ABSTRACT
The Tipitapa river is the only superficial conection between the two great lakes of Nicaragua, Xolotlán and Cocibolca. This intermittent scenario has caused concern because there are many studies that show that Xolotlán contains high levels of total mercury (a highly toxic metal) in sediment and fish. The aim of this study was to assess the levels of total mercury (HgT) in two species of fish (tilapias and guapotes) consumed by the population that live in the Tipitapa River sector in order to estimate human health risks. The 59 fish samples were obtained by direct purchase from fishermen in the El Diablillo and San Juan de la Plywood area (tilapia n=31 and guapote n=28). The HgT analyses on fish muscles were performed by atomic absorption spectrometry with cold steam generation. The wet weight concentrations of HgT determined in guapotes varied between 0,018 to 0,176 mg.kg-1 and in the tilapias varied from less than the detection limit (<ld =0,005 mg.kg-1) to 0,007 mg.kg-1. All the obtained results were below the maximum limit recommended by the World Health Organization for human consumption (0,5 mg.kg-1). No significant Spearman correlations were determined between length (p=0,324) and weight (p=0,243) versus HgT concentration in tilapias; neither in guapotes (p=0,261 and p=0,079, respectively). The HgT content found in piscivorous fish (guapote) was significantly higher (p=0,000) than the detected in omnivorous fish (tilapias). These findings imply that tilapia from Tipitapa river is a safe fish species in terms of mercury for human populations that live near the river as well as cheap, followed by the guapote.
Key words: piscivorous fish, omnivorou fishs, Tipitapa river, mercury.
INTRODUCCIÓN
El río Tipitapa es la única conexión superficial no continua que une a los dos grandes lagos de Nicaragua, el Xolotlán y el Cocibolca. Este escenario intermitente ha causado preocupación porque hay muchos estudios que muestran que el lago Xolotlán contiene altos niveles de concentración de mercurio (Hg) en agua, sedimento y peces (Lacayo, Cruz, Lacayo, & Fomsgaard, 1991; ENACAL & CIRA/UNAN-Managua, 2008). Principalmente en los sedimentos de la zona donde estuvo ubicada la fábrica cloro-álcali Penwalt S.A.-ELPESA, donde se estima un depósito aproximado de 40 toneladas de Hg elemental (Wyrick, 1981).
Esta potencial exportación de Hg del Xolotlán hacia el Cocibolca resultaría en la contaminación de biota (flora y fauna) así como la de humanos debido su transferencia a través de las cadenas alimenticias. La exposición a altas concentarciones de Hg pueden ocasionar graves daño tales como desequilibrio mental, anencefalia, entre otros, aunque su toxicidad varía considerablemente con la forma química prevaleciente (Cassidy & Furr, 1978; Clarkson, Hamada, & Amin-Zaki, 1984).
En este contexto, el metilmercurio (MeHg) es la forma orgánica más común del Hg es 100 veces más tóxica que la inorgánica; y la que más rapidamente es asimilada por la biota, especialmente por los peces (Friberg & Vostal, 1972). De hecho, Wiener & Spry (1996) sugieren que entre el 95-99% del mercurio total en peces puede corresponder a MeHg. Por lo que el propósito de este trabajo fue evaluar las concentraciones de mercurio total en dos especies de peces que habitan en el río Tipitapa para estimar los riesgos a la salud de la población debido a su consumo. Las especies estudiadas fueron tilapia (Oreochromis sp.) y guapote (Parachromis managüensis), ya que son las más comunes en la zona y en consecuencia muy demandadas por la población que habita en los alrededores.
MATERIALES Y MÉTODOS
Área de estudio
El río Tipitapa abarca principalmente al acuífero interlago de Tisma, que está localizado a 15 km al Este de Managua, en la vertiente Pacífica de Nicaragua, entre el área de descarga del lago Xolotlán y el lago Cocibolca, en la Depresión nicaragüense de la cuenca hidrológica del río San Juan que es una de las más importantes del país por su extensión y potencial hidrológico (Arriola, 2012). El estudio se realizó en dos sitios de San Juan de la Plywood, ubicados en la ribera del río Tipitapa, municipio de Tipitapa (Fig. 1).
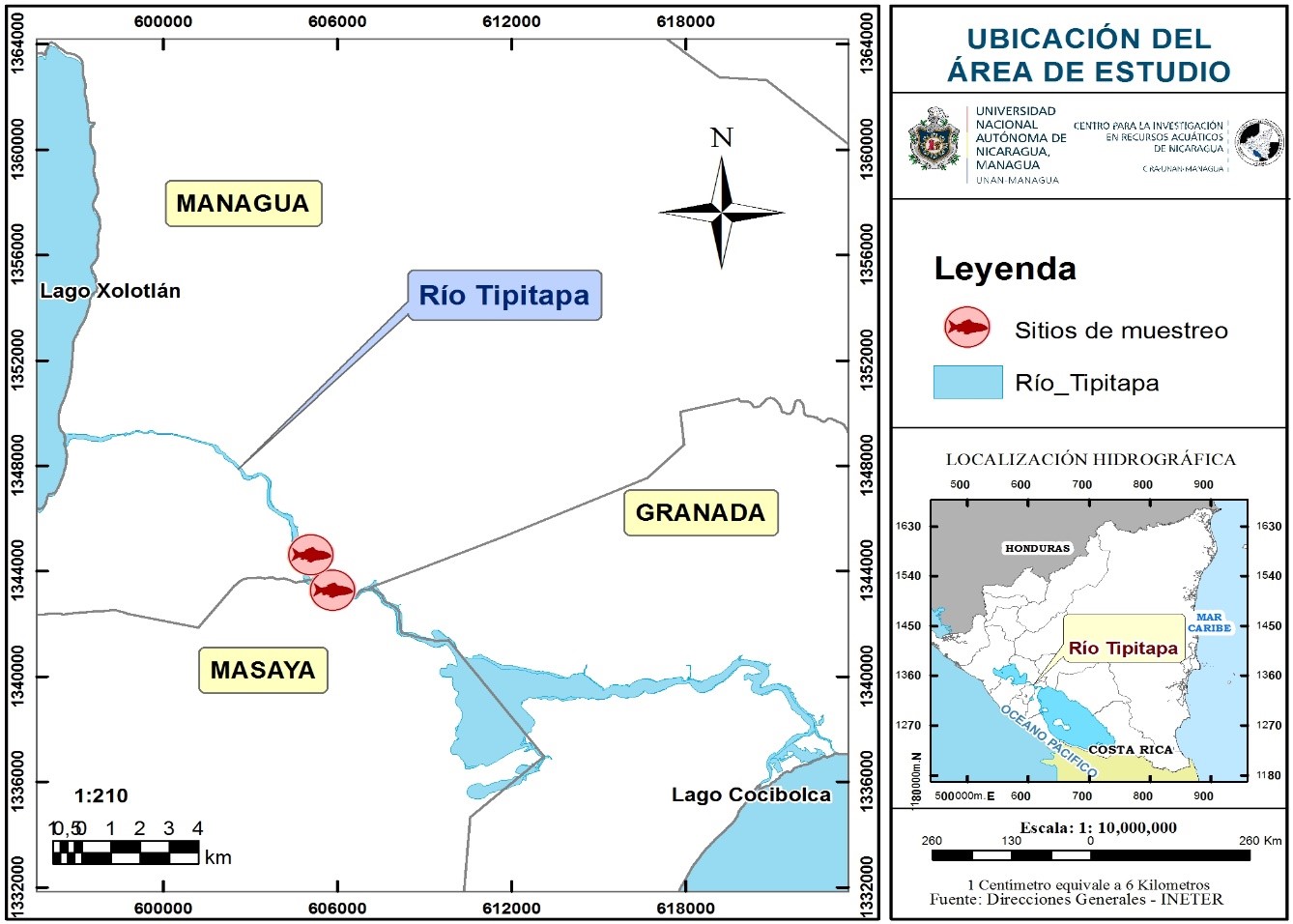
Fig. 1. Ubicación de los dos sitios de muestreo (El Diablillo y San Juan de la Plywood) en al área de estudio, Río Tipitapa, 2016.
Diseño del muestreo
Se realizaron dos muestreos: uno de reconocimiento de la zona de estudio y un segundo para la recolecta de las muestras de peces en marzo del 2016. Las muestras de peces se obtuvieron mediante la compra directa a los pescadores de la zona El Diablillo y San Juan de la Plywood. Se obtuvieron 59 muestras de las dos especies en estudio, tilapia (Oreochromis sp., n=31) y guapote (Parachromis managüensis, n=28).
Las muestras fueron almacenadas en bolsas plásticas de polietileno lineal de baja densidad (LLDPE, por sus siglas en inglés) de cierre hermético y refrigeradas en una hielera para mantenerlas entre 4-8°C, hasta su transporte al CIRA/UNAN-Managua. Luego fueron congeladas a -60°C (ULT1790-10-D, Thermo Scientific). Las muestras se descongelaron, enjuagaron con agua destilada y se secaron para proceder a la identificación de las especies, medición (longitud en cm) y pesaje (kilogramos). Una porción del músculo, tejido comestible de los peces fue removido de la parte dorsal usando un bisturí de acero inoxidable. A continuacion el tejido fue homogenizado y guardado en viales de vidrio con tapa y almacenados en un congelador hasta su posterior análisis.
Procedimiento analítico
Para la determinación del Hg en peces se utilizó método NIMD (MEJ, 2004). Se pesaron de 0,2 a 0,5 g de muestra que fueron digestadas en medio ácido (HNO3-HClO4 y H2SO4 1:1:1:5) en un balón de 50 ml con agitación y que posteriormente fueron calentadas entre 200-230 °C durante 30 minutos. Con el objetivo de verificar la calidad analítica de los lotes analizados se incluyeron muestras de Material de Referencia Certificado (Dogfish muscle, DORM-2) producido por el National Research Council of Canada (NRC). La detección y cuantificación del Hg fue realizada empleando la técnica de espectrofotometría de absorción atómica con vapor frío, usando un analizador semiautomático de mercurio (HG-201, Sanso Seisakusho Co., Ltd.). El límite de detección del método determinado fue de 0,005 mg.kg-1.
Análisis de los datos
Toda la información generada en la caracterización de las especies y los resultados de análisis de Hg fueron procesados con el programa estadístico IBM-SPSS versión 20. Los resultados de mercurio por sitio de muestreo fueron analizados usando la prueba no parámetrica de Mann Whitney. También se calculó el coeficiente de correlación de Spearman para conocer el grado de asociación entre las variables longitud y peso versus las concentraciones de Hg total ( α= 5%).
Las concentraciones de Hg detectadas en los músculos de los peces analizados se evaluaron realizando comparaciones con el valor guía sugerido para el consumo humano (0,5 mg.kg-1) de la Organización Mundial de la Salud (WHO por sus siglas en inglés) (WHO, 1989). Para el procesamiento estadístico de los resultados menores al límite de detección (< ld) se procedió a incluir el valor de la mitad del límite de detección (0,0025 mg.kg-1) que es el procedimiento más comúnmente implementado en estos casos (método de sustitución simple) (USGS, 2002).
RESULTADOS
Concentraciones de mercurio total en peces y niveles tróficos.
Las concentraciones de mercurio total (HgT) en peso húmedo detectadas en muestras de músculo en peces oscilaron desde valores menores que el límite de detección (<ld = 0,005) a 0,007 mg/kg (Tabla 1, Fig. 2). Las concentraciones de HgT detectadas para ambas especies estuvieron muy por debajo del límite permisibles para consumo humano de peces que es de 0,5 mg.kg-1 (OMS, 1989).
Tabla 1. Concentraciones de Hg total (mg.kg-1, peso húmedo) determinadas en muestras de músculo, longitud (cm) y peso (kg) de 61 especímenes de peces colectados en dos sitios sobre el río Tipitapa, 2016.
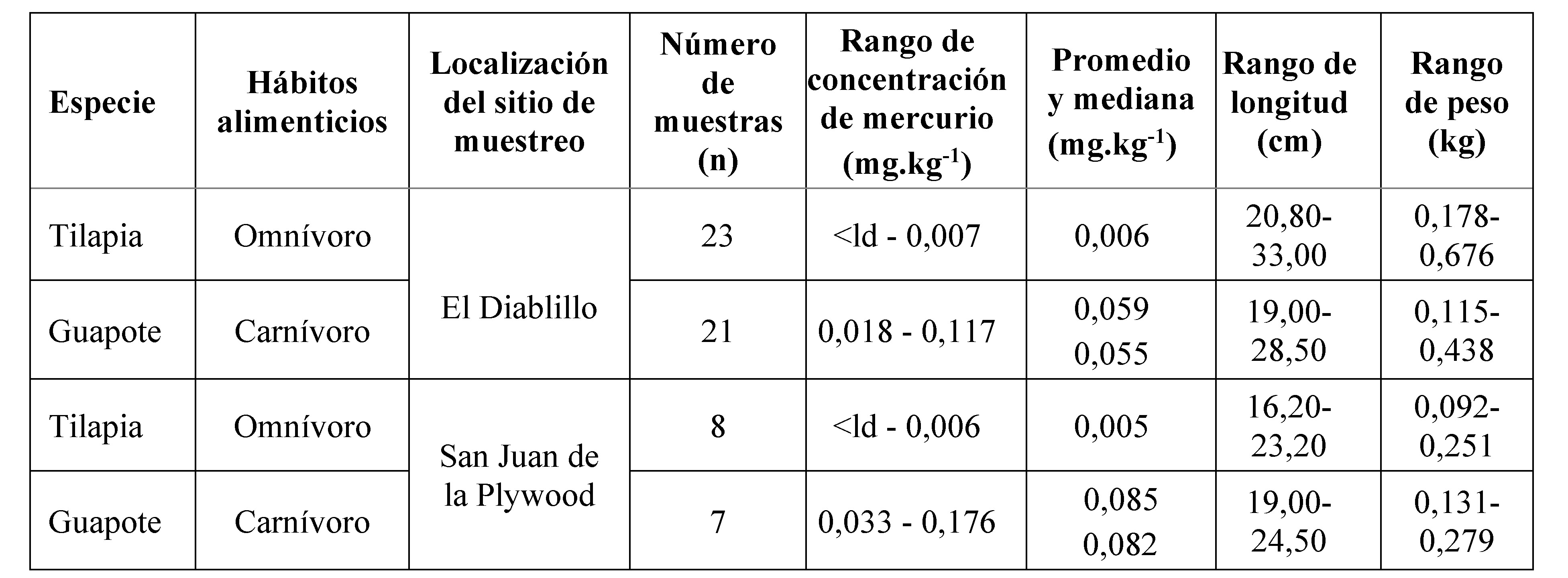
< ld: concentración menor al límite de detección (0,005 mg.kg-1).
Las concentraciones de HgT reportadas para las tilapias fueron 10 veces menores que las concentraciones que presentaron los guapotes, y en muchas de ellas se reportaron concentraciones por debajo del límite detección. Sin embargo, los resultados obtenidos en las especies estudiadas no mostraron diferencias significativas por sitio de muestreo (tilapias p= 0,190 y guapotes p= 0,326).
El contenido de mercurio encontrado en los peces piscívoros (guapotes) fue significativamente más alto que el detectado en las tilapias (p = 0,000) (Fig. 2). Estas diferencias se podrían atribuir a los diferentes hábitos alimenticios de las especies de peces estudiadas, debido a que la tilapia se alimenta de fitoplancton y detritos orgánicos; mientras el guapote es un depredador natural y está en la cúspide de la pirámide alimenticia, se alimenta de peces de menor tamaño y de pequeños crustáceos (Bussing, 2008).
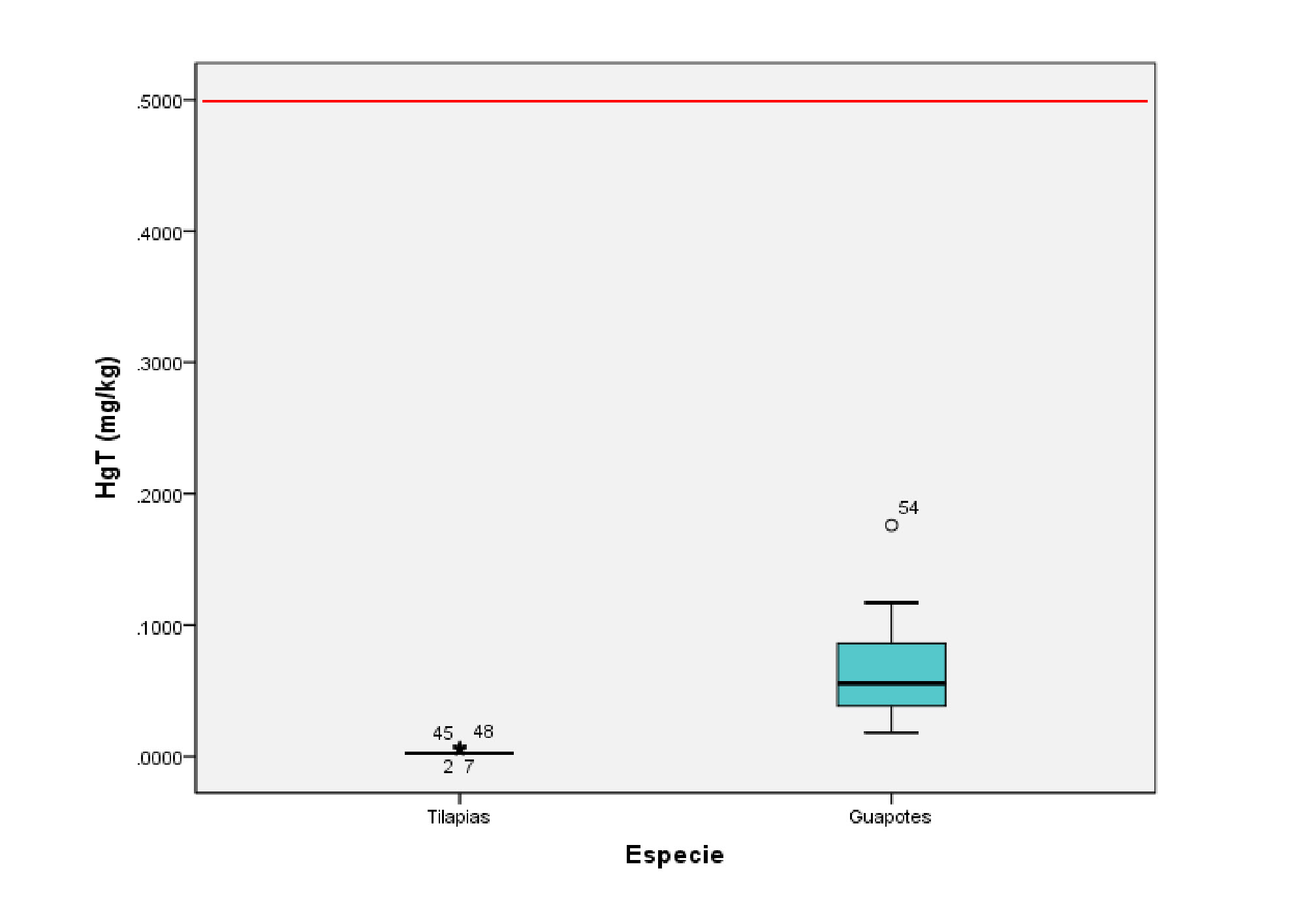
Fig. 2. Concentraciones de HgT determinadas en 59 muestras de músculo de las dos especies de peces estudiados (percentiles 25, 50 y 75) en comparación con el límite permisible para consumo humano (0,5 mg.kg-1, OMS, 1989).
Longitud y peso de los peces y su relación con la concentración de Hg total.
Las longitudes de los especímenes de tilapia colectados oscilaron entre 16,2 y 33,0 cm y el peso entre 0,092 y 0,676 kg; y en los guapotes entre 19,0 y 28,5 cm y 0,112 y 0,438 kg, respectivamente (Tabla 1). Los coeficientes de correlación de Spearman calculados para la relación entre Longitud (cm) versus Concentración de mercurio total (mg.kg-1) en especímenes de tilapia y guapote fueron -0,183 y 0,22, respectivamente (Fig. 3a y 3c). Sin embargo, estas correlaciones resultaron no significativas (p= 0,324 y 0,243, respectivamente) y en el caso de la tilapia fue negativa, o sea al aumentar la longitud disminuyó la concentración de mercurio total acumulada en el músculo. Los coeficientes calculados para la relación entre Peso (cm) versus Concentración de mercurio total (mg.kg-1) fueron -0,216 y 0,340, para tilapia y guapote, respectivamente (Fig. 3b y 3d). Estas correlaciones también resultaron no significativas (p= 0,261 y 0,079, respectivamente) y negativa para la tilapia, o sea al aumentar el peso disminuyó la concentración de mercurio total acumulada en el músculo.
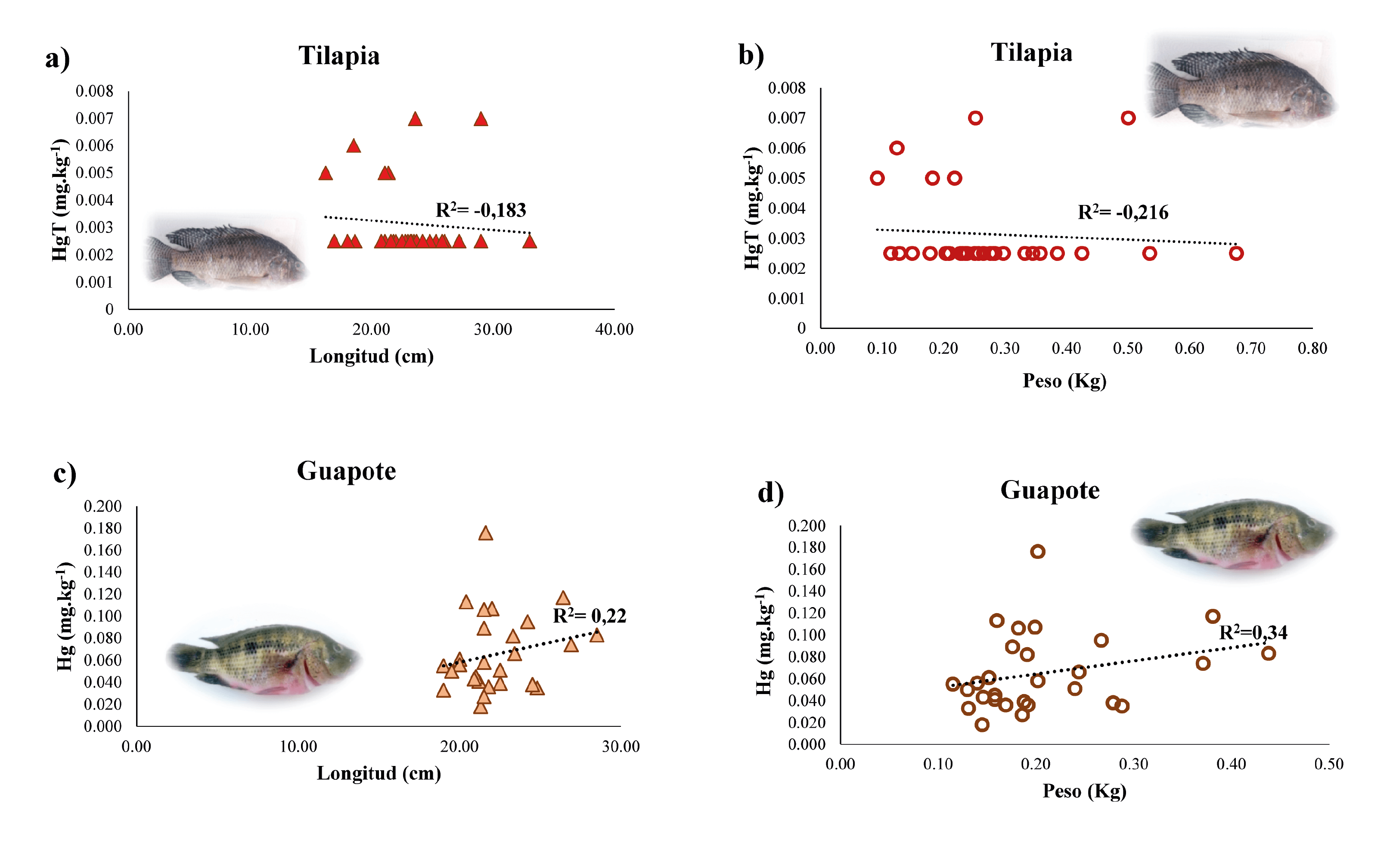
Fig. 3. Correlaciones de Spearman (no significativas) entre Longitud (cm) y Peso (kg) versus Concentración de mercurio total en músculo (mg.kg-1) de especímenes de tilapia (a, b) y guapote (c, d) colectados en los sitios El Diablillo y San Juan de la Plywood en el río Tipitapa. 2016.
DISCUSIÓN
Dado que no existen estudios previos donde se hayan evaluado las concentraciones de Hg en los peces del río Tipitapa, estos se compararon con las reportadas para las mismas especies en el lago Xolotlán. En tres estudios realizados en el Lago Xolotlán las concentraciones de Hg detectadas en los guapotes siempre han sido mayores a las detectadas en las otras especies estudiadas ya sean mojarras (2 a 28 veces) o tilapias (7 a 278 veces) (Lacayo, Cruz, Lacayo & Fomsgaard, 1991; ENACAL, 2008 y Fierro, 2017).
Esta investigación reportó concentraciones de Hg en tilapias más bajas que las reportadas en los estudios del lago Xolotlán (3 a 4 veces), probablemente debido a los distintos niveles de contaminación en los sedimentos de ambos ecosistemas, ya que se han reportado hasta 8,48 mg.kg-1 para el Xolotlán (Fierro, 2017) o en el patrón de acumulación de mercurio (Sackett et al., 2013). Sin embargo, en ambos casos las concentraciones encontradas en las tilapias están muy por debajo de lo recomendado por la Organización Mundial de la Salud (OMS, 1989).
Lo anterior, probablemente es debido a la posición de la tilapia en la cadena trófica y sus hábitos alimenticios (omnívoro con preferencia herbívora) (Phillips, Lenhart, & Gregory, 1980; Lacerda et al., 1994; Burger et al., 2001) aunque hay otros autores que sugieren que las tilapias tienen capacidad de tolerar sustancias tóxicas (Saavedra, Mayorga, & Miranda, 1996) y otros que la especie no muestra alta capacidad de bioacumulación de mercurio (Lindqvist et al., 1991; Ikingura & Akagi, 1996).
Otros autores han relacionado las diferencias en concentración de Hg entre especies a diferencias en longevidad, la tasa de crecimiento y otros factores fisiológicos y ecológicos (Huckabee, Elwood, & Hildebrand, 1979). Aunque en este estudio no se demostraron correlaciones entre las concentraciones de Hg y el peso o la longitud total de los peces, que también ya ha sido reportado en la literatura (Gutiérrez, 2001; Cizdziel, Hinners, Pollard, Heithmar, & Cross 2002). La implicación práctica de estos hallazgos es que la tilapia del río Tipitapa es una especie inocua en términos de mercurio para el consumo de las poblaciones humanas que habitan cerca del río además de barata; seguida por el guapote.
CONCLUSIONES
Las concentraciones de Hg determinadas en muestras de músculo de las especies estudiadas tilapia (Oreochromis sp., n=28) y guapote (Parachromis managüensis, n=31) en dos sitios del río Tipitapa (El Diablillo y San Juan de la Plywood) no excedieron los valores de referencia para consumo humano (0,5 mg.kg-1), por lo cual no representan un riesgo potencial importante a la salud humana debido a su ingesta. Las mayores concentraciones de Hg se detectaron en los los guapotes probablemente debido a su posición en la cadena alimenticia (carnívoro) con respecto a las tilapias (omnívoro con preferencia herbívora). No se observó relación significativa entre la longitud y el peso de las especies estudiadas versus las concentraciones de Hg ni diferencias significativas por sitio de colecta.
AGRADECIMIENTOS
Esta investigación recibió el apoyo financiero de los Fondos para Proyectos de Investigación (FPI No. 9201504) otorgados por el Vicerrectorado de investigación, postgrado y extensión de la UNAN-Managua) y de la contraparte institucional del CIRA/UNAN-Managua.
REFERENCIAS
Arriola, M. (2012). Modelamiento Númeico de la Dinámica de Flujo Subterráneo del Acuífero de Tisma, para Evaluar la Conectividad entre los Lagos Xolotlán y Cocibolca. Managua.
Arriola, M. (2012). Modelamiento Numérico de la Dinámica de Flujo Subterráneo del Acuífero de Tisma, para Evaluar la Conectividad entre los Lagos Xolotlán y Cocibolca (Tesis de Maestría). Universidad Nacional Autónoma de Nicaragua. Managua, Nicaragua.
Burger, J., Gaines, K. F., Boring, C. S., Stephens, W. L., Snodgrass, J. J., & Gochfeld, M. (2001). Mercury and Selenium in Fish from the Savannah River: Species, trophic level and locational differences. Environmental Research, Section A 87, 108-118.
Bussing, W. (2008). Peces de las aguas continentales de Costa Rica (Vol. Segunda edición). San José: Editorial de la Universidad Nacional de Costa Rica.
Cassidy, D. R., & Furr, A. (1978). Toxicity of inorganic and organic mercury compounds in animals. In: Toxicity of heavy metals in the environment. Part1. New York: Ed.F.W. Oheme, Marcel Dekker Inc.
Cizdziel, J. V., Hinners, T. A., Pollard, J. E., Heithmar, E. M., & Cross, C. L. (2002). Mercury concentrations in fish from Lake Mead, USA, related to fish size, condition, trophic level,location,and consumption risk. Archives of environment contamination of toxicology 43, 309-317.
Clarkson, T. W., Hamada, R., & Amin-Zaki, L. (1984). Mercury. In: Changing Metals Cycles and Human Health. Berlin: Springer-Verlag.
ENACAL & CIRA/UNAN-Managua. (2008). Monitoreo de la calidad del agua del lago Xolotlán. Managua.
ENACAL (Empresa Nicaraguense de Acueductos y Alcantarillado) . (2008). Monitoreo de la calidad del agua del lago Xolotlán. Managua.
Fierro, B. (2017). Evaluación de los niveles de mercurio en el agua, sedimento y peces del lago Xolotlán, Nicaragua. (Tesis de Maestría) Universidad Nacional Autónoma de Nicaragua. Managua, Nicaragua.
Fierro, B. (2017). Evaluación de los niveles de mercurio en el agua, sedimento y peces del lago Xolotlán, Nicaragua. Fuentes naturales y antropogénicas. Managua, Nicaragua.
Friberg, I., & Vostal, J. (1972). Mercury in the environment . Boca Ratón, Florida: CRC Press, Inc.
Gutiérrez, M. (2001). Niveles de concentración de mercurio total en tilapia en los sitios de pesca de las comunidades pesqueras del lago Xolotlán. Encuentro, 91-102.
Huckabee, J. W., Elwood, J. W., & Hildebrand, S. G. (1979). Accumulation of Mercury in Freshwater Biota, in the Biogeochemistry of Mercury in the Environment. (J. Nriagu, Ed.) Elsevier/North-Holland Biomedical Press, 277-302.
Ikingura, J. R., & Akagi, H. (1996). Monitoring of fish and human exposure to mercury due to gold mining in the like Victoria, Goldfiels, Tanzania. The Science of the Total Environment(191), 59-68.
Lacayo, M., Cruz, A., Lacayo, J., & Fomsgaard, I. (1991). Mercury contamination in lake Xolotlan (Managua). Journal of the Netherlands Hydrobiological Society, 25(2), 173-176. Lacayo, M., Cruz, A.,
Lacayo, J., & Fomsgaard, I. (1991). Mercury contamination in lake Xolotlan (Managua). Journal of the Netherlands Hydrobiological Society, 173-176.
Lacerda, L. D., Bidone, E. D., Guimaraes, A. F., & Spfeiffer, W. C. (1994). Mercury distribution in fish from the Itacaiúnas-Parauapebas river system, Carajas regions, Amazon. Anais Academia Brasileira de Ciencias(66), 373-379.
Lindqvist, O., Johansson, K., Bringmark, L., Timm, B., Aastrup, M., Anderson, A., . . . Meili, M. (1991). Mercury in the Swedish environment: recent research on causes, consequences and corrective methods. Water Air and Soil Pollution, 55, 1-261.
MEJ, Ministry of the Environment Japan. (2004). Mercury Analysis Manual. Mercury Analysis Manual. Japan.
Phillips, G. R., Lenhart, T. E., & Gregory, R. W. (1980). Relation between trophic position and mercury accumulation among fishes from the Tongue River Reservoir, Montana. Environmental Research(22), 73-80.
Saavedra, M. A. (1996). Introducción al cultivo de tilapia (Reporte técnico). Centro de Investigaciones de Ecosistemas Acuáticos (CIDEA, UCA). Managua: NA/MEDEPESCA.
Saavedra, M. A., Mayorga, A., & Miranda, A. (1996). Cultivo de Tilapia: Curso Básico Cultivo de tilapia. Managua. Managua: NA/MEDEPESCA.
Sackett, D. K., Cope, W. G., Rice, J. A., & Aday, D. D. (2013). The influence of fish length on tissue mercury dnamics: Implications for natural resource management and human health risk. International Journal of Environmental Research and Public Health., 2(10), 638-659.
USGS (United States Geological Survey). (2002). Statistical Methods in Water Resources. En D. R. Helsel, & R. M. Hirsch, Techniques of Water-Resources Investigations of the United States Geological Survey book4, Hydrologic Analysis and Interpretation. Obtenido de https://pubs.usgs.gov/twri/twri4a3/pdf/twri4a3-new.pdf
WHO, W. H. (1989). Environmental Health Criteria 86. Mercury Environmental Aspect. Finland.
WHO, W. H. (1989). Environmental Health Criteria 86, 1-115. Mercury Environmental Aspect. Geneva.
WHO, World Health Organization. (1989). IPCS, INCHEM. Obtenido de IPCS, INCHEM: http://www.inchem.org/documents/ehc/ehc/ehc086.htm
Wiener, J. G., & Spry, D. J. (1996). Toxicological significance of mercury in freshwater fish. In: Environmental contaminants in Wildlife: Interpreting Tissue Concentrations. (G. H.-N. W. N. Beyer, Ed.) Boca Ratón, Florida: Boca Raton. FL: CRC Press.
Wyrick, B. (1981). Chemical Plant´s Poison Inflames a Nation. Hazards for export. Newsday, USA.

