
|
Año 2018 | Vol.4, 11 – 22 |

|
|---|
Obtención de carbón activado a partir de la cáscara del fruto del jícaro sabanero (Crescentia alata).
Francisco Picado Pavón1*, Felipe Mendoza Arriaza1, Fabricio Castro Granados1.
1 Centro para la Investigación en Recursos Acuáticos de Nicaragua (CIRA/UNAN-Managua).
RESUMEN
El carbón activado es un adsorbente utilizado para múltiples propósitos, en especial para la remediación de agua contaminada. Los miembros de la Asociación de Campesinos y Artesanos (ADECAB) en Villanueva-Chinandega, Nicaragua obtiene artesanalmente carbón a partir de la cáscara de jícaro sabanero (Crescentia alata) con el propósito de utilizarlo como lecho filtrante para mejorar la calidad del agua que consumen y para obtener un beneficio económico adicional a través de su comercialización. Los objetivos de este estudio fueron conocer la calidad del carbón producido por los asociados de ADECAB y obtener carbón activado a escala de laboratorio con una calidad comparable a la de un carbón de laboratorio. Esto se logró a través de ensayos de laboratorio que involucraron: a) limpieza, secado y reducción del tamaño de la cáscara cruda, b) carbonización y activación química de la cáscara y c) reducción de tamaño del carbón. Estos ensayos también sirvieron para detectar las limitaciones del proceso artesanal. La pre-carbonización a 400 °C y la activación química con soluciones acuosas de ácido fosfórico seguida de una carbonización inmediata a 600 °C fue el ensayo que resultó más exitoso para la obtención de carbón activado, el cual tiene una capacidad de adsorción al azul de metileno ligeramente superior a la del carbón de laboratorio. El rendimiento en la obtención del carbón activado fue de un 40%. La adopción de las condiciones de carbonización y activación ensayadas les permitirá a los asociados de Villanueva producir carbón activado con calidad de laboratorio y consecuentemente beneficiarse por la alta disponibilidad y bajo costos que tiene la cáscara de jícaro.
Palabras clave: Carbón, Cáscara de jícaro, carbonización, activación, adsorción.
ABSTRACT
Activated charcoal is a multipurpose sorbent commonly used in remediation of contaminated water. The members of the Association of Peasants and Artisans from Villanueva, Chinandega in Nicaragua produce charcoal in an artisanal way from shells of calabash tree fruit (jícaro sabanero, Crescentia alata) to improve the quality of drinking water and to get income by its commercialization. The aims of this work were to determine the quality of the artisanal charcoal and to produce activated charcoal at the laboratory scale from shells of C. alata fruits with a quality comparable to a laboratory grade charcoal. This was achieved through laboratory assays, which included: a) cleaning up, drying and size reduction of raw shells, b) carbonization and chemical activation of shells and c) size reduction of the obtained charcoal. These assays were also useful to detect limitations of the artisanal process. The pre- carbonization at 400 °C and the chemical activation with aqueous solutions of phosphoric acid followed by immediate carbonization at 600 °C was the most successful assay to obtain activated charcoal. This carbon had a higher adsorption capacity for methylene blue than that of the laboratory grade charcoal and yielded 40%. The adoption of the carbonization and activation conditions assayed will allow the associates in Villanueva to produce an activated charcoal with laboratory grade quality and consequently benefit from the high availability and low costs of the jícaro shells.
Key words: Charcoal, jícaro shell, carbonization, activation, sorption.
INTRODUCCIÓN
El carbón activado es un adsorbente utilizado para múltiples propósitos (Wang, Hung, & Shammas, 2005). En el campo de la purificación y remediación de aguas (McGuire & Suffet, 1983) por su naturaleza anfótera y su versatilidad para adsorber gran diversidad de compuestos orgánicos (Mohammad-Khah & Ansari, 2009) y en menor medida para adsorber iones metálicos (El-Hendawy, 2003).
El carbón activado es obtenido eficientemente a través de la carbonización térmica y activación química de diversos materiales carbonáceos (referencias en (Al-Qodah & Shawabkah, 2009), entre los cuales están las maderas livianas, el bagazo de la caña, la cubierta dura del coco y otras materias primas incluyendo la sangre animal. El carbón activado tiene una estructura altamente porosa ya que los átomos de carbono están asociados a través de enlaces químicos covalentes carbono-carbono (McDougall & Hancock, 1981). A lo interno de las partículas de carbón estos átomos tienen un arreglo estructural que les permite compartir sus electrones en cualquier dirección, en cambio los átomos de carbono sobre la superficie de la partícula se encuentran en desequilibrio de fuerzas, lo cual les permite interactuar con otras moléculas del fluido que los rodea. La adhesión física (adsorción) de los solutos sobre la superficie del carbón activado tiene lugar cuando la atracción molecular entre el soluto y el carbón es superior a la existente entre el soluto y el solvente. Este proceso es reversible y es el mecanismo de remoción aprovechado para el tratamiento de las aguas y aguas de desechos (Tseng, Wu, & Juang, 2003).
El área superficial efectiva para la adsorción es la superficie de los poros más la superficie externa de cada partícula de carbón, siendo la primera mucho más grande que esta última, tal que la mayor adsorción tiene lugar en las superficies de los poros. De aquí la importancia de obtener una mayor porosidad en el carbón. Adicionalmente, la relación entre la superficie total y la masa del carbón activado debe ser lo más grande posible y esto es lo que se desea como producto final. El área superficial del carbón activado granular puede variar desde 600 hasta 1 050 m2/g, el volumen de los poros entre 0,6 y 0,95 g/cm3 y la humedad ya empacado entre 1 y 2% (Wang, Hung, & Shammas, 2005). Esta información nos ofrece un escenario a cerca de la variación de las propiedades del carbón activado las cuales dependen de la calidad de la materia prima (Radovic & Rodríguez, 1996) utilizada para la obtención del mismo, de las condiciones y del medio para llevar a cabo la carbonización (Moreno-Piraján, Giraldo, Baquero, Briceño, & Díaz, 2003) y la consecuente activación del carbón (Adewumi, 2006), así como del tamaño de partículas del carbón (Prías, Rojas, Echeverry, Fonthal, & Ariza, 2011).
En este estudio se exponen los resultados de tres ensayos de laboratorio basados en la carbonización térmica y la activación química que demuestran que la cubierta del fruto del jícaro sabanero (Crescentia alata) es idónea para producir carbón activado con características similares a las de un carbón activado de alta calidad para uso de laboratorio. Estos ensayos también sirvieron para detectar las limitaciones del proceso artesanal efectuado por los miembros de la Asociación para el Desarrollo de Campesinos y Artesanos de la comarca El Bonete (ADECAB) de Villanueva-Chinandega, Nicaragua.
MATERIALES Y MÉTODOS
Caracterización del carbón producido por ADECAB en Villanueva
La ADECAB produce carbón a través de la carbonización de la cáscara del fruto de jícaro sabanero a una temperatura aproximada de 400 ºC durante 1h en hornos artesanales, seguida de la activación con una solución acuosa de ácido fosfórico (H3PO4), lavado y secado a ~100 ºC. Una muestra compuesta (~ 3,5 kg) de carbón producido por la ADECAB, de aquí en adelante referido como carbón artesanal, fue obtenida mezclando 300 g de carbón de diferentes bolsas de carbón artesanal procedente de un mismo lote de producción. Esta muestra y una cantidad similar de carbón activado granular Darco ®, carbón lígnitico lavado con ácido con el tamaño de partícula de 4-12 mesh de alta calidad para ser usado en investigación y desarrollo (distribuido por Sigma-Aldrich), de aquí en adelante referido como carbón de laboratorio; fueron utilizadas para ser separadamente caracterizadas en el laboratorio. Los parámetros analizados fueron: tamaño de partícula, contenido de humedad, densidad aparente, volumen de los poros, porosidad y capacidad de adsorción. Dada la homogeneidad del carbón de laboratorio, su caracterización fue realizada sin réplicas, en cambio para el carbón artesanal la caracterización fue realizada con ocho réplicas.
Tamaño de partícula
300 gramos por réplica de los dos carbones a caracterizar fueron cribados consecutivamente a través de tamices con tamaños de malla de 4,0 mm, 2,0 mm y 0,63 mm. El tamaño de partícula fue estimado a través de la ecuación 1:

En donde: R es el porcentaje del carbón retenido (%); pi y pt son respectivamente el peso del carbón retenido en cada tamiz y el peso total del carbón pasado por cada tamiz (g).
Contenido de humedad
Inicialmente 9 cápsulas de porcelana limpias y secas fueron pesadas repetidamente en una balanza analítica (Sartorios CPA 2202S) con una precisión de 0,01 g, hasta obtener el peso constante de cada cápsula. Seguidamente, ocho réplicas de 50 g del carbón artesanal y una muestra de 50 g del carbón de laboratorio fueron pesadas por separado en cada una de las cápsulas hasta obtener un peso constante (peso inicial del carbón) y luego secadas en un horno durante 1h (Fisher Scientific ISOTEMP 550-126) a 120ºC±3ºC. Posteriormente las muestras fueron retiradas del horno y enfriadas en un desecador. Una vez alcanzada la temperatura ambiente, las muestras fueron pesadas nuevamente hasta obtener un peso constante (peso final del carbón).
El porcentaje de humedad (H) fue determinado a través de la ecuación 2:

En donde: Pi es el peso inicial del carbón (g) y Pf es el peso final del carbón (g) después del secado al horno.
Densidad aparente
Alícuotas de las muestras de carbón de laboratorio y de carbón artesanal fueron agregadas en probetas graduadas de 250 ml, agitando suavemente y permitiendo libremente la deposición del carbón hasta alcanzar un volumen de 100 ml. Las cantidades de carbón en las probetas fueron posteriormente pesados en una balanza analítica (Sartorius, CPA 2202S). La densidad aparente de ambas muestras de carbón fue determinada con la ecuación 3:

En donde: D es la densidad (g/ml), M es el peso del carbón (g) y V es el volumen ocupado en la probeta por el carbón (ml)
Volumen de poros
El volumen de los poros fue determinado en 10 ocasiones al carbón de laboratorio y en 10 ocasiones a 8 réplicas de carbón artesanal, al cual se le hizo el análisis granulométrico previo. Este volumen fue determinado hirviendo 5 g de las muestras en 60 ml de agua destilada durante 1 h para desplazar el aire contenido en los poros del carbón. Posteriormente las muestras fueron extendidas sobre un papel absorbente para su secado superficial a temperatura ambiente (~ 28 ⁰C) durante 45 minutos. Finalmente, las muestras de carbón fueron pesadas nuevamente en una balanza analítica (Sartorius, TE 214S) con una precisión de 0,0001 g.
Para el cálculo del volumen de poros (Vp) se consideró el aumento en el peso del carbón dividido entre la densidad del agua destilada utilizada (ρ25⁰C ~ 0,99713 g/ml). Este volumen de los poros en ml/g fue calculado a través de la ecuación 4:

En donde, mh es la masa del carbón hervido y secado superficialmente (g), ms es la masa del carbón antes de hervirlo (g) y ρagua densidad del agua a 25 ºC g/ml.
Porosidad
Para determinar la porosidad fue necesario determinar el volumen de poros y el volumen específico total tanto del carbón artesanal como del carbón industrial, la cual fue calculada tomando el inverso de los valores de la densidad aparente previamente determinada. Por tanto, la porosidad se estimó a través de la ecuación 5.

En donde, P es la porosidad o fracción de espacios vacíos en el carbón, Vp: Volumen de poros (ml/g) del carbón y D es la densidad aparente del carbón (g/ml).
Capacidad de adsorción
La capacidad de adsorción se midió exponiendo tanto al carbón artesanal como al de laboratorio al colorante azul de metileno (C16H18ClN3S, Fisher, CAS 7220-79-3).
Se preparó una curva de calibración a partir de una solución de azul de metileno de 0,1 mM, con seis concentraciones desde 0,001 hasta 0,025 mM a las que se les midió absorbancia en un espectrofotómetro Lambda XLS Perkin Elmer a una longitud de onda de 620 nm.
La ecuación obtenida (ecuación 6) y coeficiente de regresión lineal de la curva de calibración preparada con estándares de azul de metileno y utilizada para cuantificar la cantidad retenida por el carbón, fueron:
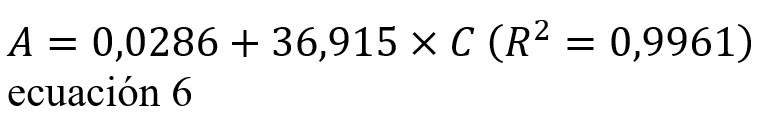
En donde C es la concentración del azul de metileno en mM y A es la absorbancia.
Posteriormente, dos alícuotas de las muestras de carbón de cada tipo fueron pesadas para obtener un peso aproximado de 0,15 a 0,20 g. Seguidamente todas las muestras fueron depositadas separadamente en 100 ml de azul de metileno 0,1 mM y agitadas durante 45 minutos. Al finalizar el tiempo de agitación, las soluciones fueron separadas de cada muestra de carbón y se les midió las absorbancias.
A través de la curva de calibración del azul de metileno y las absorbancias resultantes se obtuvieron las concentraciones finales del azul de metileno en la solución final, para cada muestra del ensayo, a través de la siguiente ecuación 7:
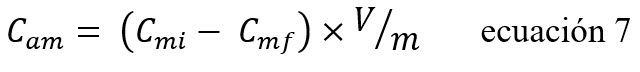
En donde: Cam es la concentración del azul de metileno adsorbido por gramos de carbón (mM/g), Cmi y Cmf son las concentraciones respectivas en mM del azul de metileno al inicio y al final del ensayo (proceso de adsorción), m es la masa carbón y V es el volumen de la solución de azul de metileno en litro.
Primer ensayo: Activación + carbonización inmediata
La cáscara seca de jícaro proporcionada por la ADECAB fue fragmentada manualmente hasta obtener un tamaño entre 1-2 pulgadas. Cuatro réplicas de 50 g fueron pesadas en cápsulas de porcelanas en una balanza analítica (Sartorios, CPA 2202S, precisión de 0,01 g). Seguidamente cada réplica fue depositada por separado en vasos de precipitado Pyrex de 500 ml e impregnadas con solución de ácido fosfórico al 85 (H3PO4), dos réplicas al 10 % y las otras dos al 20% para ser agitadas durante 20 minutos en un agitador magnético Equatherm 267-955. Posteriormente, las cáscaras impregnadas fueron transferidas a cápsulas de porcelana previamente pesadas y pesadas nuevamente para seguidamente ser carbonizadas en una mufla Fisher Scientific S56-126 a 600 ºC durante una hora.
Finalmente, las cuatro muestras de carbón obtenidas fueron colocadas en vasos de precipitado Pyrex de 500 ml con agua destilada (~ 500 ml) y agitadas durante 20 minutos en un agitador magnético para remover el ácido fosfórico remanente y otras sustancias como cenizas que pudiesen haberse formado. El agua destilada fue reemplazada en cinco ocasiones hasta obtener un agua con un pH neutro (pH=7). Posteriormente, el agua remanente fue decantada y el carbón activado fue secado durante 1 h a 105 °C para remover cenizas y otras impurezas que pudiesen quedar adheridas al carbón activado.
Segundo ensayo: Pre-carbonización y activación + carbonización inmediata.
Para este ensayo, cuatro réplicas de 50 g de la cáscara de jícaro fragmentada fueron pesadas en cápsulas de porcelana en una balanza Sartorius CPA 22025 con una precisión de 0,01 g y posteriormente pre-carbonizadas en una mufla Fisher Scientific S56-126 a una temperatura de 400 °C durante 1 h. Después de la pre-carbonización las cáscaras fueron enfriadas y dos réplicas fueron impregnadas en solución de H3PO4 al 10 % y las otras dos al 20%, y agitadas durante 20 minutos en un agitador magnético Equatherm 267-955. Posteriormente las cáscaras impregnadas fueron carbonizadas en una mufla Fisher Scientific S56-126 a una temperatura de 600 °C durante 1 h. Finalmente, el carbón obtenido fue lavado y secado al igual que en el primer ensayo.
Tercer ensayo: Pre-carbonización y activación + carbonización inmediata con reducción de los tiempos de carbonizado y de activado y activación con ácido fosfórico al 20%.
Este ensayo se realizó siguiendo el mismo procedimiento y bajo las mismas condiciones del segundo ensayo, salvo que la impregnación se hizo únicamente con ácido fosfórico al 20% y se redujo el tiempo de carbonizado y activado a 45, 30 y a 25 minutos. El contenido de humedad y la capacidad de absorción del carbón obtenido en cada uno de los ensayos fueron medidas siguiendo los procedimientos descritos en la caracterización del carbón producido en Villanueva por la ADECAB.
RESULTADOS Y DISCUSIÓN
Caracterización del carbón producido por ADECAB en Villanueva
La distribución del tamaño de partículas del carbón artesanal y del de laboratorio resultaron ser muy diferentes, incluso la variabilidad entre réplicas del carbón artesanal, expresada por el coeficiente de variación fue alta (Tabla 1). Estos resultados están directamente asociados a la forma artesanal en que la ADECAB realiza la reducción de tamaño de la cáscara carbonizada, lo cual hace que el carbón producido sea menos homogéneo en la distribución del tamaño de partículas y consecuentemente tenga una densidad aparente inferior, en un 22%, a la del carbón de laboratorio (Tabla 2).
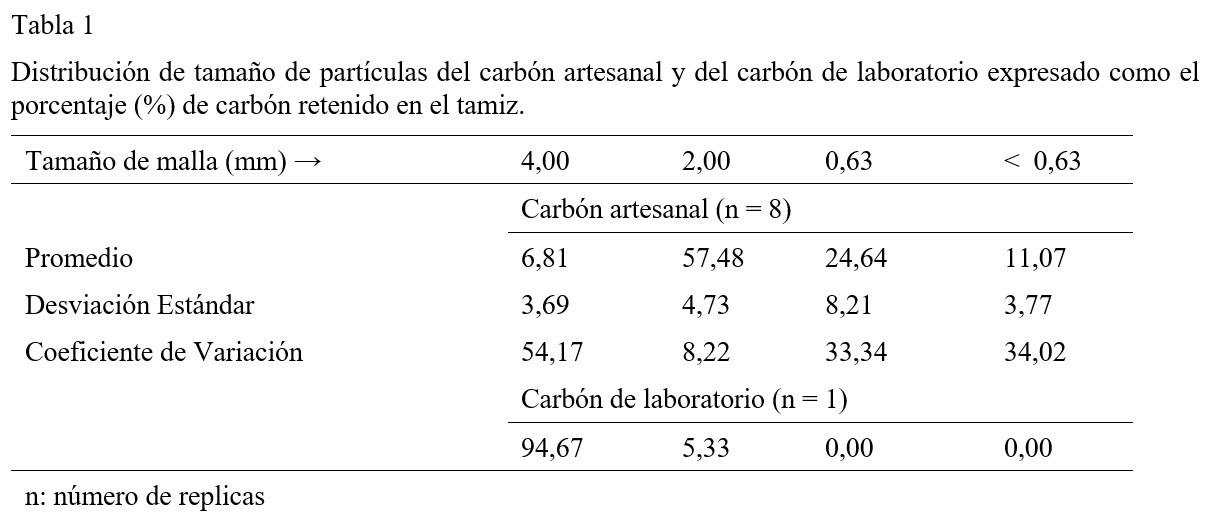
En cuanto a los valores promedio de humedad, el carbón artesanal contiene casi ocho veces la humedad contenida en el carbón de laboratorio (Tabla 2). El contenido de humedad, el cual varía grandemente (CV ~ 16) en el carbón artesanal, podría ser atribuida simultáneamente a la heterogeneidad en el tamaño de grano, el cual da lugar a un 20% (Tabla 3) de variación en la porosidad de este carbón, y a la composición química de la superficie del carbón la cual interactúa eficientemente con las moléculas de agua a través de la formación de puentes de hidrógeno. Adicionalmente, la alta humedad en el carbón artesanal también puede ser atribuida a la ineficiente remoción del ácido fosfórico posterior a su activación, la cual podría estar disminuyendo su carácter hidrófobo (Radovic, Moreno-Castilla, & Rivera-Utrilla, 2001)
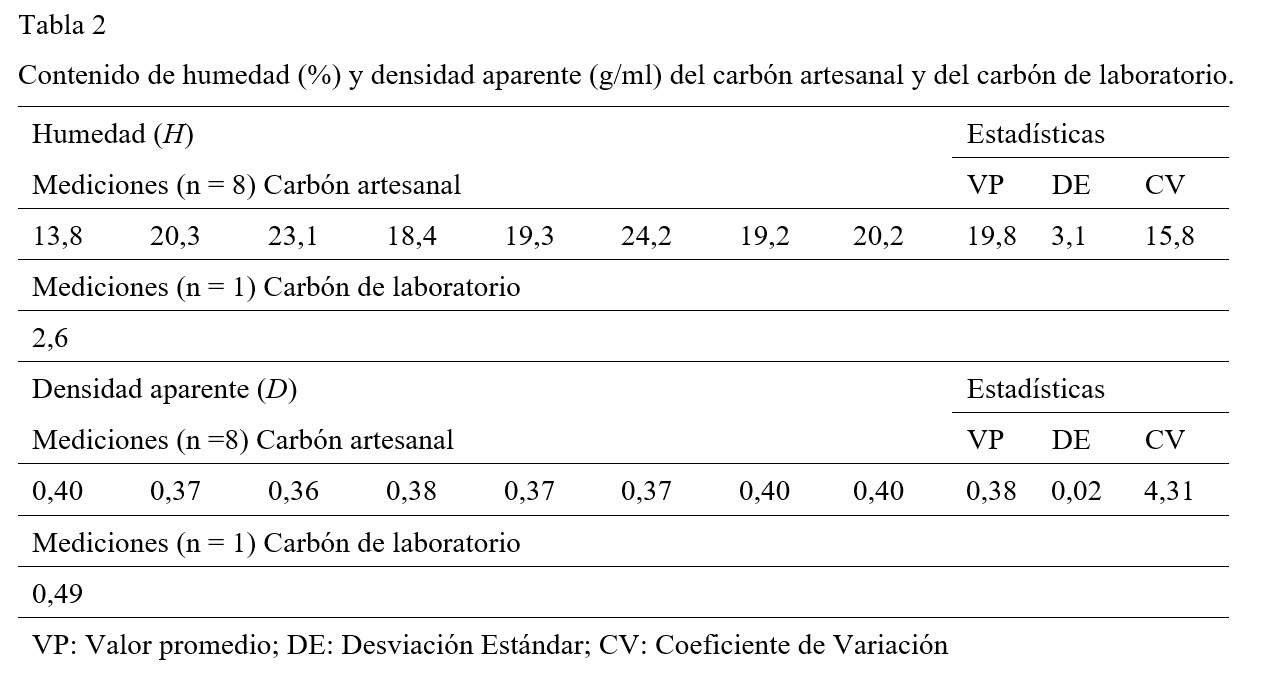
El valor promedio de porosidad del carbón artesanal resultó ser inferior al del carbón de laboratorio (Tabla 3). Esto indica una formación deficiente en la cantidad de poros en el carbón artesanal, así como una distribución heterogénea de los mismos reflejada en la desviación estándar correspondiente al volumen de poro del carbón artesanal (Tabla 3), la cual representa un 23% del valor promedio de esta propiedad. Probablemente estos resultados estén asociados a las condiciones inadecuadas de temperatura de carbonización y/o a la de activación a la que es sometida la cáscara de jícaro en el proceso artesanal, ya que la formación de poros en el carbón está en dependencia de esta variable (Díaz, Briceño, Baquero, Giraldo, & Moreno, 2002) (Prías, Rojas, Echeverry, Fonthal, & Ariza, 2011). Sin embargo, al juzgar por el volumen de los poros ambos carbones tienen valores superiores al valor de 0,2 ml/g, el cual los clasifica como carbón activado. La solución residual de azul de metileno, después de exponer el carbón artesanal dio una absorbancia de 1,633, la cual corresponde a una concentración residual de azul de metileno de 0,043 mM. La concentración adsorbida por este carbón fue de 0,028 mM/g. En tanto para el carbón de laboratorio la solución residual dio una absorbancia de 0,050 y corresponde a una concentración adsorbida de 0,049 mM/g, la cual indica una adsorción efectiva. Estos resultados podrían indicar que ambos carbones difieren en su composición química superficial resultante, ya que esta infiere el carácter básico o ácido (Montes-Morán, Suárez, Menéndez, & Fuente, 2004), así como en sus microestructuras.
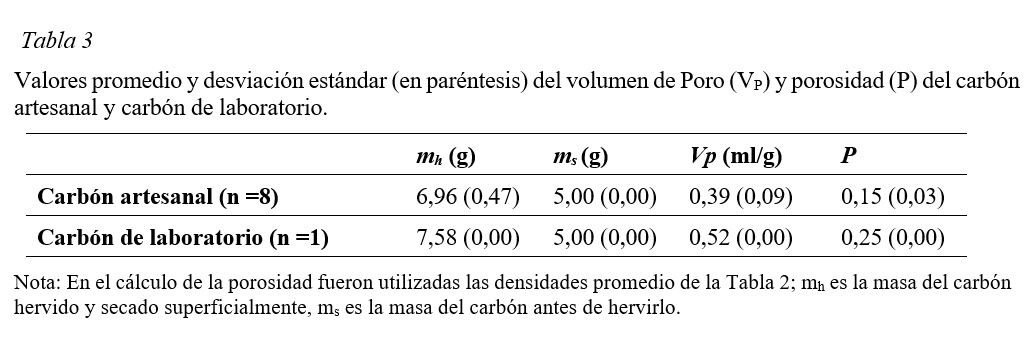
Primer ensayo: Activación + carbonización inmediata
En este primer ensayo se obtuvo una capacidad de retención del azul de metileno en el carbón que va desde nula hasta un valor muy bajo (Tabla 4), lo cual sugiere una escasa formación de poros en el carbón, hecho que puede estar relacionado con la composición química y/o bajo contenido de carbón que tiene la cáscara cruda de jícaro (Montes-Morán, Suárez, Menéndez, & Fuente, 2004) y su interacción con la solución activadora. En la activación tiene lugar una reacción térmica en donde la estructura del carbón es alterada y se forman poros de diferentes tamaños (Mohammad-Khah & Ansari, 2009) dando lugar a que los átomos de carbono se dispongan en un arreglo estructural muy peculiar a lo interno y en la superficie de las partículas que interactúan de forma directa o a través de los grupos funcionales (Mohammad-Khah & Ansari, 2009) formados con los solutos a su alrededor presentes en los fluidos (Bandosz, 2006). Según estos resultados (Tabla 4), la solución activadora es más eficiente en la creación de los poros cuando la misma es más concentrada.
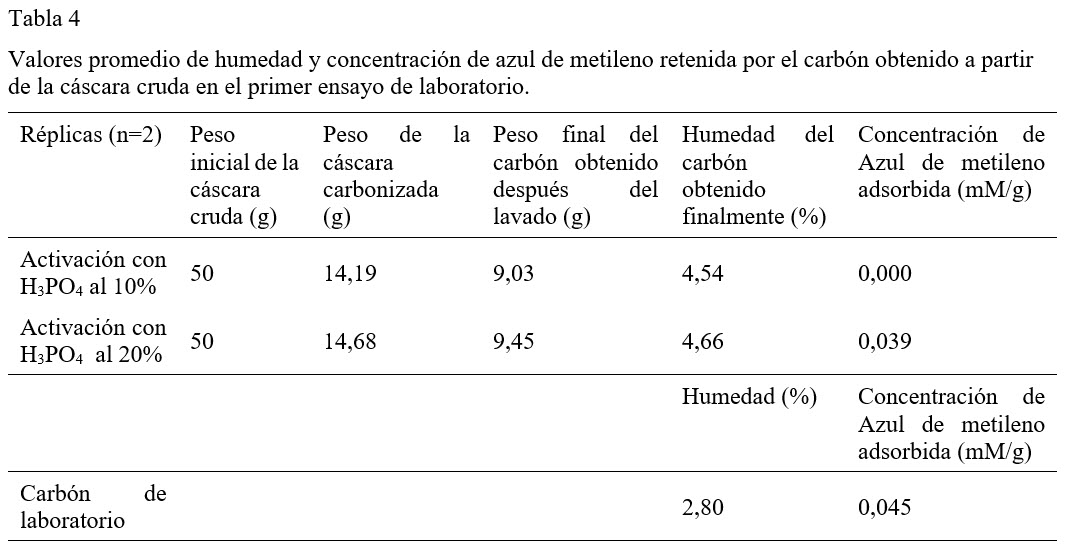
Segundo ensayo: Pre-carbonización y activación + carbonización inmediata.
A diferencia del primer ensayo, los resultados de este ensayo sugieren que la formación de poros es más efectiva con un pre-carbonizado de la cáscara cruda y con una mayor exposición cuantitativa a la solución activadora (Tabla 5). El pre-carbonizado logra eliminar muchas sustancias volátiles que interfieren en la formación de los poros en el carbón y permeabilizan la superficie evitando la interacción con la solución activadora. A como se puede observar en la Tabla 5, el % de humedad del carbón obtenido es bajo en comparación con los resultados del primer ensayo, lo cual indica que el pre-carbonizado ayuda a mejorar la hidrofobicidad del carbón (Radovic, Moreno-Castilla, & Rivera-Utrilla, 2001).
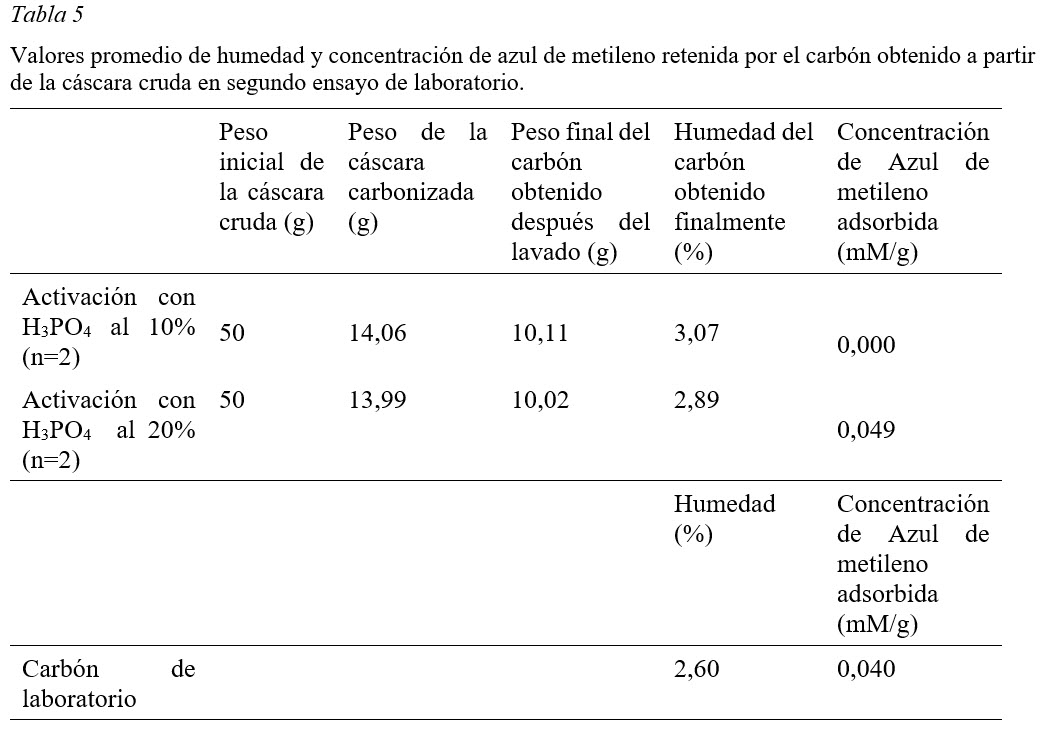
Tercer ensayo: Pre-carbonización y activación + carbonización inmediata con reducción de los tiempos de carbonizado y de activado; y activación con ácido fosfórico al 20%.
Basado en los resultados de humedad y la concentración de azul de metileno adsorbida por el carbón obtenido en este ensayo, se pudo observar que el tiempo necesario de carbonización y activación es de 45 minutos. En los ensayos anteriores este tiempo fue de 1 h. En este ensayo el carbón obtenido presentó un porcentaje de humedad la cual varía ligeramente en función del tiempo de carbonización y activación (Tabla 6). El tiempo de carbonizado y activación asociados a un contenido reducido de humedad y a una mayor adsorción de azul de metileno en comparación con las propiedades del carbón de laboratorio es de 45 minutos. Aunque no era objeto de cuantificación en los ensayos también se observó que el rendimiento en cuanto a la cantidad de cáscara utilizada y la cantidad de carbón activado obtenido en este ensayo fue alto (28 a 41% en peso) en comparación con los dos ensayos anteriores.
De acuerdo a los resultados de la caracterización se demostró que, bajo las condiciones artesanales, los cooperativistas de la ADECAB en Villanueva obtienen de la cubierta del fruto de jícaro un carbón con características disímiles al carbón activado de laboratorio, sin embargo, también se demostró en los ensayos de laboratorio que se puede obtener carbón activado de buena calidad con esta misma materia prima.
CONCLUSIONES Y RECOMENDACIONES
La cáscara del fruto del jícaro (Cresentía alata) es materia prima idónea para la obtención de un carbón activado con calidad de laboratorio. Esta calidad se logró obtener a través de una pre-carbonización de la cáscara cruda a 400 °C y la activación con H3PO4 al 20% seguido de una carbonización inmediata a 600 °C.
AGRADECIMIENTOS
Al Centro para la Investigación en Recursos Acuáticos de Nicaragua (CIRA/UNAN-Managua), Universidad Nacional Autónoma de Nicaragua, Managua, Nicaragua. A la Asociación para el Desarrollo Campesino y Artesano El Bonete (ADECAB), especialmente a los líderes de la asociación, los señores Isidro Ríos Sánchez, Natividad Ríos y Manrique Ramón Aguilera.
REFERENCIAS
Adewumi, I. (2006). Characterization andSpecification of Activated Charcoal Produced from Palm Kernel Shells for Water Treatment. Doctoral dissertation, PhD. thesis. Obafemi Awolowo University, Ile-Ife.
Al-Qodah, Z., & Shawabkah, R. (2009). Production and Characterization of granular activated carbon from activated sludge. Brazilian Journal of Chemical Engineering, 26(1), 127-136. doi:10.1590/S0104-66322009000100012
Bandosz, T. J. (2006). Activated Carbon Surfaces in Environmental Remediation (1st ed., Vol. 7). Elsevier.
Díaz, C. M., Briceño, N., Baquero, M. C., Giraldo, L., & Moreno, J. C. (2002). Caracterización textural y química de carbón activado obtenido a partir de cuesco de palma africana a diferentes condiciones de temperatura y tiempo de carbonización. Revista Colombiana de Química, 31(2), 119-129.
El-Hendawy, A. A. (2003). Influence of HNO3 oxidation on the structured and adsorptive properties of corncob activated carbon. Carbon, 41, 713-722. doi:10.1016/S0008-6223(03)00029-0
McDougall, G. J., & Hancock, R. D. (1981). Gold complexes ad activated carbon. Gold Bulletin, 14(4), 138-153.
McGuire , M., & Suffet, I. (1983). Treatment of water by granular activated carbon (2nd ed.). Washington D. C.: American Chemical Society. doi:10.1021/ba-1983-0202
Mohammad-Khah, A., & Ansari, R. (2009). Activated Charcoal: Preparation, Characterizartion and Applications: A review article. International Journal of ChemTech Research, 1(4), 859-864.
Montes-Morán, M., Suárez, D., Menéndez, J., & Fuente, E. (2004). On the nature of basic sites on carbon surface: an overview. Carbon, 42(7), 1219-1225. doi:10.1016/j.carbon.2004.01.023
Moreno-Piraján, J. C., Giraldo, L., Baquero, M., Briceño, N., & Díaz, C. (2003). Influence of temperature in the processes of carbonization and activation with CO2 in the obtainment of activated carbon from African palm pit. Study of the modification of characterization parameters. Internet Journal of Chemistry, 6(1).
Prías, J. J., Rojas, C. A., Echeverry, N. A., Fonthal, G., & Ariza, H. (2011). Identificación de las variables óptimas para la obtención de carbón activado a partir del precursor Guadua angustifolia Kunth. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 35(135), 157-166.
Radovic, L., & Rodríguez, F. (1996). Chemistry and Physics of Carbon. In P. A. Thrower (Ed.). NY: Marcel Dekker, Inc.
Radovic, L., Moreno-Castilla, C., & Rivera-Utrilla, J. (2001). Carbon Materials as Adsorbents in Aqueous Solutions. In Chemistry and Physics of Carbon. A Serie of Advances (Vol. 27, pp. 227-406). New York: Marcel Dekker, Inc.
Tseng, R. L., Wu, F. C., & Juang, R. S. (2003). Liquid-fase adsorption of dyes and phenols using pinewood-based activated carbons. Carbon, 41, 487-495. doi:10.1016/S0008-6223(02)00367-6
Wang, L., Hung, Y., & Shammas, N. (2005). Handbook of Environmental Engineering. Volume 3: Physiochemical Treatment Processes. Totowa, NJ: The Humana Press Inc.