
Metástasis óseas y radioterapia paliativa en el Centro Nacional de Radioterapia Nora Astorga, 2012-2017
Bone metastases and palliative radiotherapy at the Nora Astorga National Radiotherapy Center, 2012-2017
Frank Soto1,2, Ivon Chon1,3, Ana I. Ocampo1,2, Hugo Marsiglia5, Manuel E. Pedroza4, Fernando Silva5.
1Ministerio de Salud de Nicaragua (MINSA),2Departamento de Radioterapia, Centro Nacional de Radioterapia Nora Astorga, 3Instituto de Oncología y Radioterapia de la Habana, Cuba, 4Facultad de Ciencias Médicas, UNAN-Managua, 5Fundaciòn Arturo López Pérez (FALP), Santiago de Chile.
franksoto161178@yahoo.es
RESUMEN
En el Centro Nacional de Radioterapia Nora Astorga (CNRNA) se analizó la situación actual del manejo radioterapéutico paliativo de los pacientes oncológicos con metástasis óseas de enero 2012 a marzo 2017. El método de estudio utilizado fue el descriptivo, analítico, no experimental, retrospectivo y de corte transversal. Se tomó como fuente de referencia la base de datos del Registro del Cáncer (REGCAN4-CNR), para analizar la información se utilizó el software estadístico INFOSTAT versión 2017.
Entre los principales resultados se destacan una mayor incidencia de casos en el sexo femenino (65%) con una relación hombre-mujer (1:1.9); el 64% de los pacientes se encontró en el rango de mayores de 50 años. Las principales enfermedades oncológicas que presentaron metástasis óseas son mama, próstata, cáncer cérvico uterino (CaCu) y pulmón, con un descenso porcentual al 2016 del 14%.
El sitio santuario más frecuente de metástasis ósea fue la columna dorsal y lumbar en el 48%. Posdiagnóstico histopatológico y culminación del tratamiento general, la sobrevida libre de enfermedad ósea metastásica para el estadio clínico-patológico fue de aproximadamente 22.1 meses. La radioterapia externa paliativa más utilizada fue la planificación 2D, con esquemas hipofraccionados de 8Gy en dosis única. Radiodermitis y la enteritis grado I y II fueron las complicaciones agudas más comunes. Mejorías en el control del dolor fueron observadas a los 11 días posradioterapia paliativa (RTP). La sobrevida global de pacientes posdiagnóstico de metástasis óseas es del 63% a los 13.5 meses. La sobrevida acumulada a 5 años fue del 9%.
Palabras claves: metástasis ósea, radioterapia, radioterapia paliativa con cobalto60.
ABSTRACT
We analyzed the current panorama of palliative radiotherapy management for bone metastases in cancer patients treated at the Nora Astorga from January 2012 to March 2017. We used a descriptive, analytical, non-experimental, retrospective cross-sectional method, using data from the cancer registry (REGCAN-CNR) database, analyzed with the SPSS statistics software 20 version.
Among the main results show a higher incidence of cases in the female sex (65%) with a male-female ratio (1: 1.9); 64% of patients were over 50 years. Bone metastases were present mostly in the following breast, prostate, uterine cervix and lung cancers, with annual decrease to 4%.
The most common site for bone metastases was the dorsal and lumbar column (48% of cases). Overall, survival free from bone metastases after histopalogical posdiagnosis and end of treatment for stage III disease was approximately 22,1 months. The most commonly used palliative external-beam radiotherapy was 2D planning, with hypofraccionated, single-dose 8Gy schedules. Radiodermatitis and enteritis grade I and II were the most common acute complications. Improvements in pain control were observed at 11 days after palliative radiotherapy (RTP). Patients’ overall survival after diagnosis of bone metastasis was 63% at 13, 5 months. Five-year cumulative survival was 9%.
Key Words: bone metastasis, radiotherapy, palliative radiotherapy with cobalt-60.
INTRODUCCIÓN
Las metástasis óseas (MO), es la diseminación secundaria de células cancerígenas hacia el hueso por vía hematógena, linfática y de contigüidad. En pacientes con cáncer, el hueso representa el tercer sitio santuario más común de las metástasis y el paciente que presenta esta condición limita su pronóstico de supervivencia y calidad de vida. En este contexto, la radioterapia paliativa tiene un rol importante al tener como objetivo el control de síntomas, mejorar la calidad de vida, promover la remisión y control tumoral del volumen anatómico seleccionado a irradiar.1, 2
En pacientes oncológicos a nivel mundial, se reporta que durante el transcurso de la enfermedad la MO se observa en el 35% de los casos y se diagnostican en la primera consulta al menos en el 15% de los casos,2 representando de esta manera la segunda causa más común de las urgencias oncológicas que son tratadas con radioterapia paliativa (RTP). Las enfermedades oncológicas que causan comúnmente MO son el cáncer de mama, próstata, tiroides, riñón y pulmón; sin embargo se observan importantes variaciones en su incidencia y mortalidad, siendo muy altas las tasas de frecuencia y mortalidad para el cáncer de pulmón (menos de tres meses de sobrevida), mama, próstata, linfomas, melanoma y tiroides (de 9-19 meses de sobrevida). 2, 7
El tratamiento paliativo de las metástasis óseas es personalizado y las principales herramientas terapéuticas que se disponen (RTP), quimioterapia (QT) a base de bifosfonatos, radioisótopos, cirugía paliativa y manejo del dolor; no obstante, el pronóstico y sobrevida de estos pacientes depende de muchos factores, siendo el más importante el sitio primario de la lesión, distribución de la metástasis, afectación de órganos viscerales, caquexia y funcionalidad del paciente (Perfomance Status-PS), demostrándose así que los pacientes con un ECOG (East Cooperative Oncology Group) mayor o igual a tres, índice Karnofsky (IK) menor al 50%, más caquexia y afectación de órganos viscerales, tienen una sobrevida global entre 3 y 12 meses. 3, 4, 5, 6, 7
En Nicaragua, según estadísticas del registro de cáncer del Centro Nacional de Radioterapia Nora Astorga (REGCAN4-CNRNA),23 las MO en pacientes con cáncer representan el 8% de los casos nuevos y son la primera causa de atención de las urgencias oncológicas; sin embargo a pesar de la alta incidencia nacional e institucional, se carece de evidencia científica nacional sobre el tema, por lo que en este estudio se decidió realizar un exhaustivo análisis de los pacientes con el objetivo de conocer el manejo radioterapéutico paliativo con cobalto60 (Co60), las enfermedades oncológicas y sitios anatómicos más frecuentes de MO.
MATERIALES Y MÉTODOS
Se realizó un estudio descriptivo, analítico, correlacional, no experimental, retrospectivo y de corte transversal de estudio de casos. La población objeto de estudio fue de 341 pacientes con cáncer diagnosticados con metástasis óseas, a los cuales se les aplico RTP con cobalto60 en el CNRNA, durante el período de enero 2012 a marzo 2017. La muestra tomada fue de 266 pacientes que correspondió al total de pacientes que cumplieron los criterios de inclusión y exclusión establecidos. La información se recolectó a través de la entrevista clínica de los pacientes durante y después de la RTP y/o entrevista a familiares por vía telefónica para conocer la condición del paciente, además, se hizo revisión de historia clínica y ficha de tratamiento, cuyos datos fueron analizados, según la naturaleza de cada variable en frecuencias y tablas descriptivas, aplicándoles pruebas de concordancia como prueba de Chi cuadrado y asociación de V de Cramer. Para realizar el análisis estadístico inferencial de sobrevida, se usó la prueba de Kaplan-Meier, se utilizó el software INFOSTAT versión 2017.22
RESULTADOS
La población total en estudio fue de 266 pacientes oncológicos con metástasis ósea (MO) que recibieron radioterapia paliativa (RTP), la cual se caracterizó por presentar un 65% de incidencia de casos en el sexo femenino, respecto al 35% del masculino, la mediana de edad del debut de la enfermedad fue a los 51 años (RIQ 36-67años), siendo el rango de mayores 50 años el más frecuente en el 64%, con una relación hombre-mujer de 1:1.9. (tabla 1)
Entre las principales patologías oncológicas que causaron MO, se encuentra el cáncer de mama, próstata, cáncer cérvico-uterino (CaCu) y pulmón en un 43%, 30%, 11% y 6%, respectivamente. El síntoma más común presentado por los pacientes antes del diagnóstico fue el dolor en el 73%, seguido de la anemia e hipercalcemia en un 8% y 6%, respectivamente (tabla 1).
El sitio santuario más frecuente de MO fue la columna dorsal y lumbar en el 27% y 21% de los casos, así como múltiples sitios, región pélvica, tórax y miembros superiores en el 19%, 18%, 10% y 4%, respectivamente. En el CNRNA en los últimos tres años se observó una disminución en la incidencia de casos del 14%. (tabla 1)
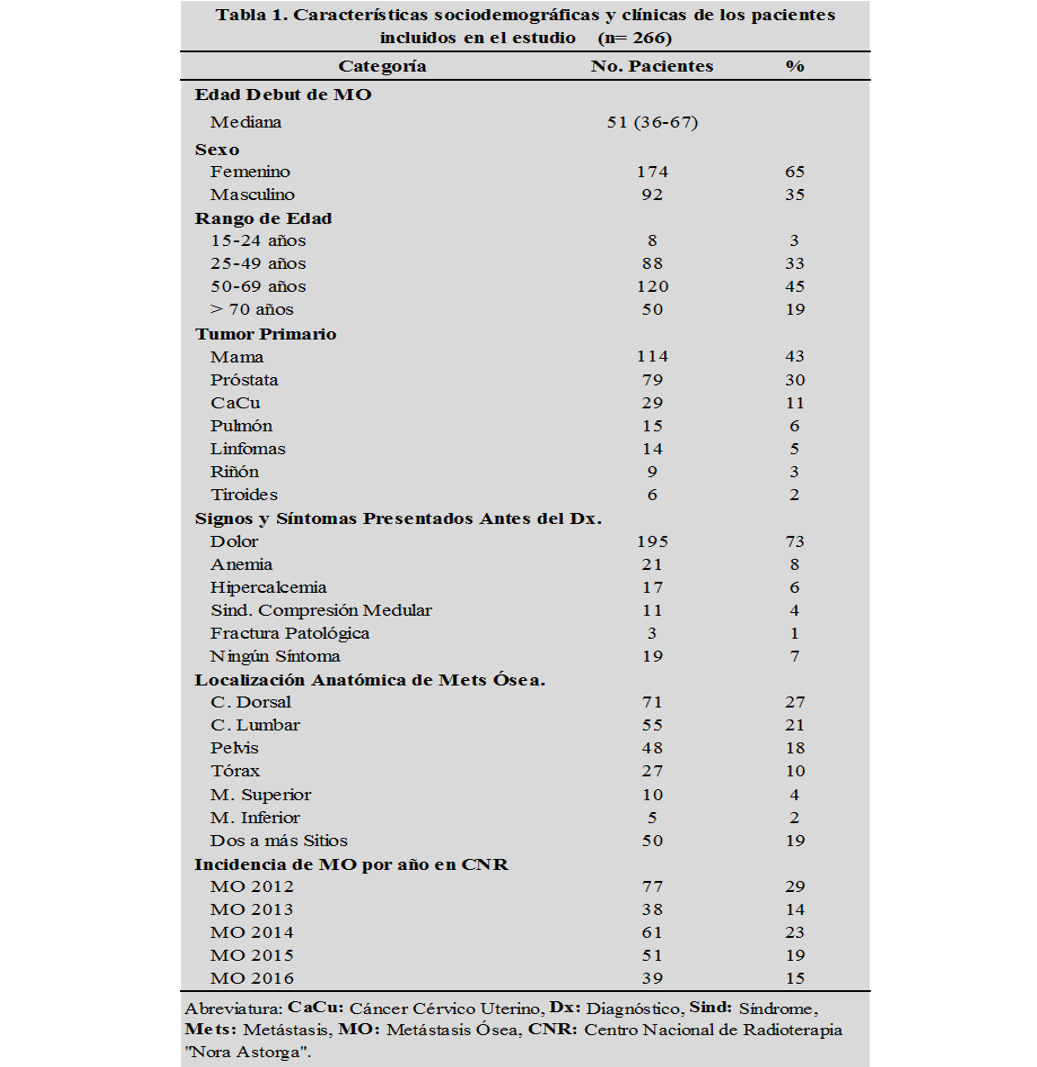
Fuente: Base de datos del CNRNA
La radioterapia externa paliativa más utilizada fue la planificación en dos dimensiones (2D) en el 98% y tres dimensiones (3D) en el 2%, con un esquema hipofraccionado de 8Gy en dosis única en el 72% de los casos, seguida de 20Gy (5fx de 4Gy) y 30Gy (10fx de 3Gy) en el 17% y 11% respectivamente. Independientemente de las dosis, en el 58% de los casos se reportaron mejorías en el control del dolor en un rango de 6-16 días posaplicación de RTP, siendo la mediana de 11 días (tabla 2).
En cuanto al manejo farmacológico sintomático del dolor por MO, el 56% de los pacientes se trataron fuera del CNRNA (FCNRNA) con anti-inflamatorios no esteroideos, seguido de un 32% con fármacos opioides débiles (tramadol), un 4% con bifosfonatos (Ac. zalendrómico), esteroides en un 5% y tan solo el 3% con opioides fuertes (morfina). Al momento de aplicación de RTP, el 60% de los pacientes se caracterizó por presentar un índice Karnofsky (IK) menor de 60% (tabla 2).
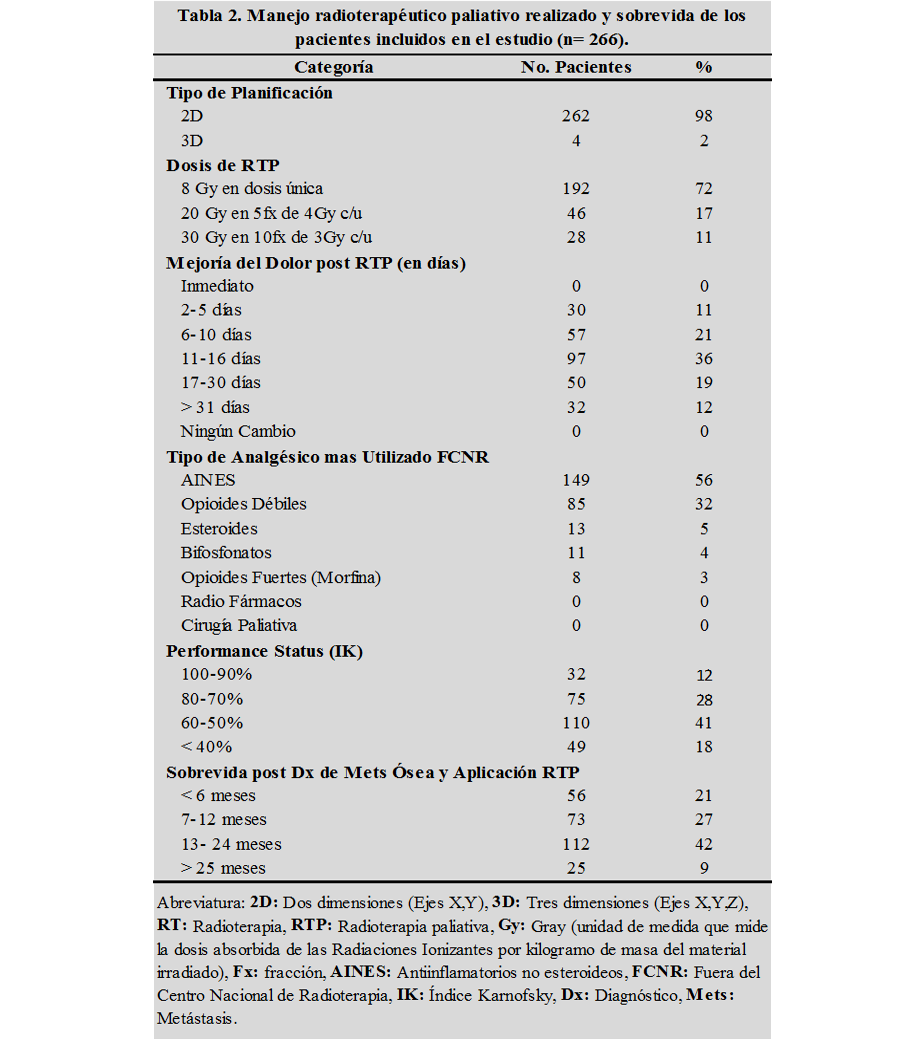
Fuente: Base de datos del CNRNA
Las complicaciones agudas se presentaron en el 29% de los casos; siendo la radio-dermitis y enteritis grado I las más comunes en el 10% y 6% así como grado II en el 2%, seguida de las complicaciones hematológicas que se observaron en el 3% de los casos, respectivamente. La razón de verosimilitudes de Chi cuadrado (p menor a 0.0001 para α igual 0.05) demostró una asociación significativa entre el grado de complicaciones agudas y dosis de RTP. (tabla 3)
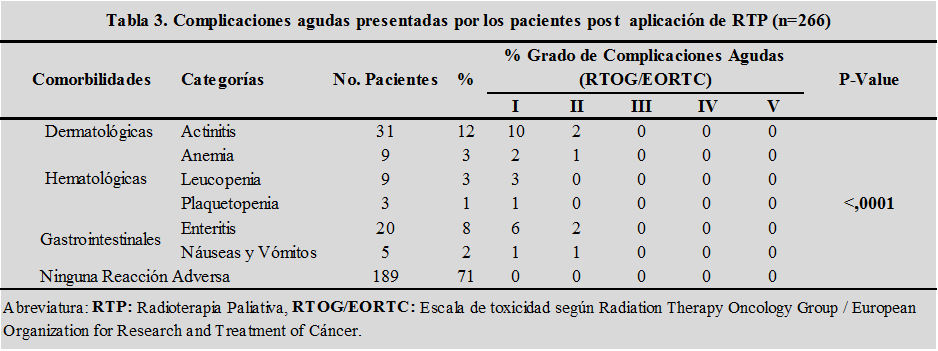
Fuente: Propia del estudio
Las MO fueron más frecuente en el estadio clínico III en un 53% de los casos; observándose un período libre de enfermedad ósea metastásica (PLEOM) postratamiento general oncológico de 22,1 meses (1,8 años), seguida de los estadios clínicos IV (39%), II (4%) y I (3%), los cuales presentaron metástasis óseas a los 8 meses, 35,3 meses y 77,5 meses, respectivamente. Las medianas de sobrevida (SV) pos-RTP fueron de 10,3 meses, 9,8 meses, 14,5 meses y 19,3 meses, respectivamente, (resultado estadísticamente no significativo por p>0,1252 para α=0,05).
No obstante, según el tumor primario, el PLEOM para el CaCu fue de 46 meses, seguida del cáncer de mama, próstata, pulmón y riñón con 37 meses, 30,7 meses, 13,5 meses y 9 meses respectivamente; con medianas de SV pos-RTP de 26,7 meses, 31,5 meses, 12,2 meses, 3 meses y 4 meses respectivamente, en donde la razón de verosimilitudes de Chi cuadrado (p<0,0001 para α = 0,05) demostró una asociación estadísticamente significativa entre el tumor primario y la presentación de MO. Al evaluar las curvas de sobrevida de Kaplan-Meier, el cáncer de riñón, tiroides y pulmón presentaron curvas de SV que decrecen más rápido, alcanzando a los 6 meses índices de sobrevida globales menores al 53%, no obstante a los 31,5 meses el cáncer de próstata, CaCu y mama, alcanzan índices de sobrevida globales del 62%, 78% y 87%, respectivamente, siendo estos resultados estadísticamente significativos por p menor a 0,0001 para α igual a 0,05. (tabla 4 y figura 3)
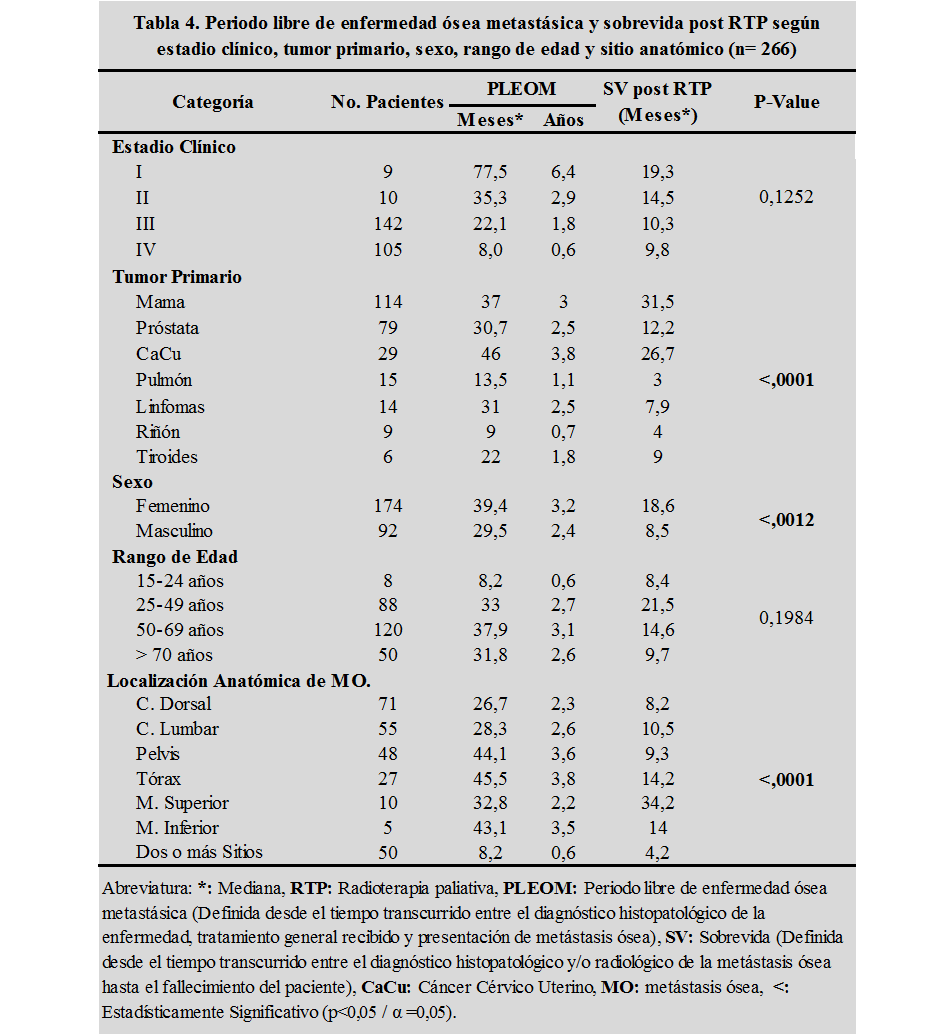
Fuente: Propia del estudio
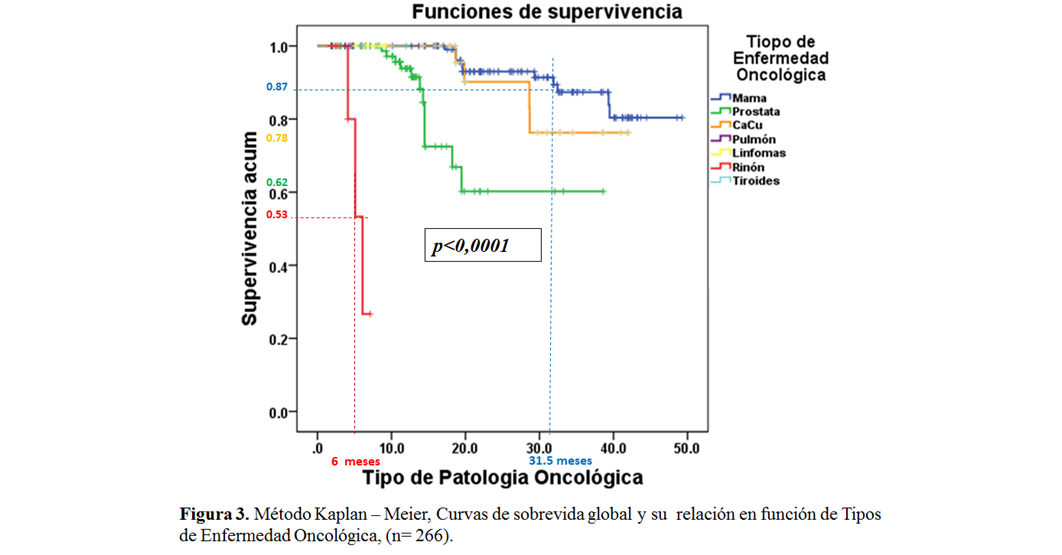
Fuente: Propia del estudio
De igual manera según el género, el PLEOM es de 39,4 meses para el sexo femenino y de 29,5 meses para el masculino, con medianas de SV pos-RTP de 18,6 meses vs 8,5 meses (estadísticamente significativo por p<0,0012 para α =0,05); según el rango de edad para menores de 24 años y mayores de 70 años, el PLEOM es de 8,2 meses y 31,8 meses, con una mediana de SV pos-RTP de 8,4 meses vs 9,7 meses (resultado estadísticamente no significativo por p>0,1984 para α = 0,05). En cuanto a la localización anatómica, se observó que el PLEOM para dos o más sitios de MO, fueron la columna dorsal y lumbar a los 8,2 meses, 26,7 meses y 28,3 meses, respectivamente, (estadísticamente significativo por p<0,0001 para α = 0,05); con una SV pos-RTP de 4,2 meses, 8,2 meses y 10,5 meses. (tabla 4)
Sin embargo, al correlacionar sobrevida global y dosis de RT se evidenció que los pacientes tratados con 8Gy en dosis única, tuvieron una mediana de sobrevida de 26 meses (2,1 años), seguida de la dosis de 30 Gy (10fx de 3Gy) y 20Gy (5fx de 4Gy) con una sobrevida de 23 y 20 meses, respectivamente, siendo estos resultados estadísticamente significativos por p<0,0032 para α = 0,05). No obstante, la proporción de sobrevida acumulada según el método actuarial a 5 años fue del 9%, con una significancia estadística de p<0,0024 para un α = 0,05. (figura 1 y 2)
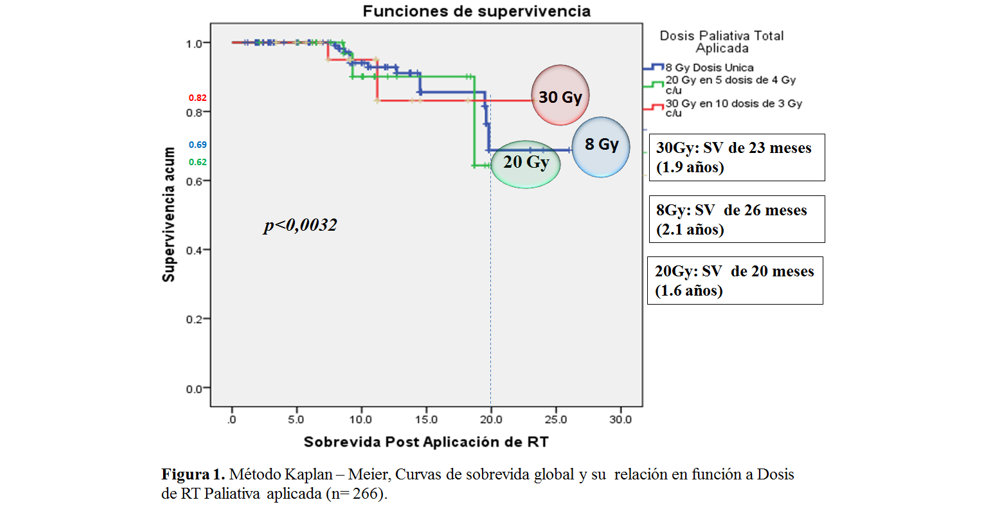
Fuente: Propia del estudio
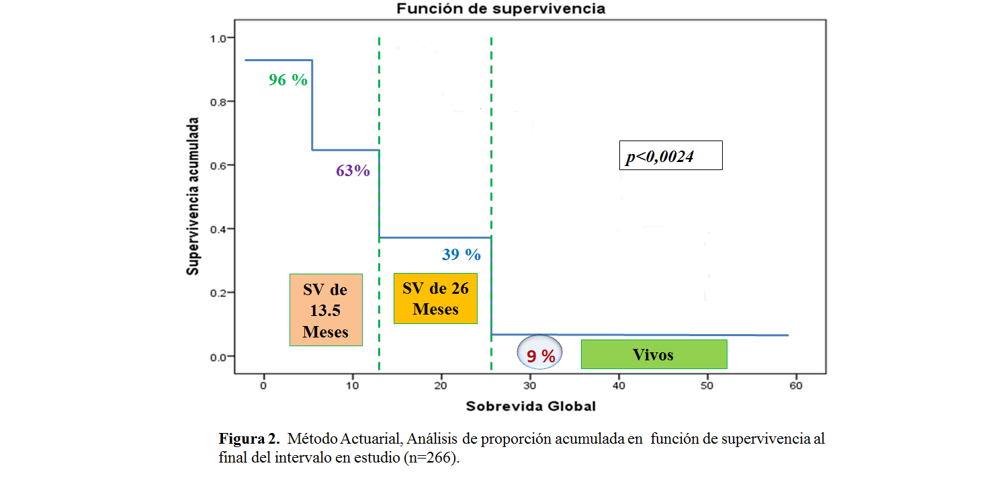
Fuente: Propia del estudio
DISCUSIÓN DE RESULTADOS
La radioterapia paliativa en pacientes oncológicos con MO tiene como objetivo el control de síntomas, mejorar la calidad de vida, promover la remisión y control tumoral del volumen anatómico seleccionado a irradiar; no es curar, ya que quienes presentan esta complicación, el pronóstico de supervivencia y calidad de vida están comprometidas.1, 2
Basados en este precepto, podemos afirmar que en el estudio, la mayor incidencia de casos se observó en el sexo femenino, con una edad de debut de MO a los 51 años; resultados que son similares a los reportados en la literatura internacional. No obstante, en cuanto a la relación hombre-mujer (1:1.9), se encontró discretas diferencias a las publicadas por 4,5 los cuales reportan que en EE.UU la relación hombre-mujer es de 1:1.5 y a nivel mundial es de 1:1.4.
En el CNRNA, el cáncer de mama, próstata, CaCu, pulmón, linfomas, riñón y tiroides fueron las patologías oncológicas más comúnmente atendidas por causar MO. Estos resultados son comparables a los reportados por 3,5,6,10 en donde la mayor prevalencia en EE.UU. de metástasis óseas se observa para el cáncer de mama (70%), próstata (60%), riñón (12%-18%), tiroides (4%-13%) y pulmón (10%). En nuestro contexto epidemiológico marca la diferencia el CaCu y linfomas, al ocupar el tercer y quinto lugar en la incidencia y prevalencia nacional con el 11% y 5% de los casos, patologías que internacionalmente no han sido reportadas como de alta incidencia metastásica. (tabla 1)
En cuanto a los síntomas más comunes presentados por los pacientes oncológicos antes del diagnóstico de MO, fue el dolor como el signo más común, seguido de anemia, hipercalcemia, estos resultados coinciden con los reportados 7, 10,11. Sin embargo es importante mencionar que además del dolor, la anemia (tipo leuco-eritro-blásticas/reportadas en la literatura internacional) e hipercalcemia, deben de ser tomados en cuenta a la hora del seguimiento oncológico, ya que el 7% de los pacientes en estudio no presentan síntomas, por lo que la interpretación y seguimiento de los resultados de biometría hemática completa (BHC) y/o fosfatasa alcalina, podría orientarnos al diagnóstico oportuno de MO. (tabla 1)
También resultados similares a los reportados por la literatura internacional 14,15,16 fueron obtenidos en cuanto al sitio santuario más frecuente de MO (columna dorsal-lumbar, múltiples sitios, región pélvica, tórax y miembros superiores); de los cuales se destacan los múltiples sitios metastásicos que se observaron con mayor frecuencia al momento del diagnóstico en pacientes con cáncer de próstata y riñón en un 19%. (tabla1)
La radioterapia externa paliativa más utilizada fue la planificación 2D en el 98% de los casos (avance tecnológico y de sistemas de planificación que se disponía hasta esa fecha en el país), siendo el esquema hipofraccionado de 8Gy en dosis única el más utilizado; observándose mejorías en el control del dolor en el rango de 6-16 días (mediana de 11 días), resultados que discrepan con los reportados por 6 en cuanto al uso de la técnica, sistema y tipos de planificación, que el más utilizado es el 3D (inherentes a la brecha tecnológica y disponibilidad de tecnología avanzada de RTP en el país), que reportan control sintomático del dolor entre 1-2 meses pos aplicación de RTP. (tabla 2)
En cuanto al manejo sintomático del dolor oncológico por MO, en su mayoría estuvo basado en la escala analgésica de la Organización Mundial de la Salud (OMS) (manejo farmacológico del dolor y de cuidados paliativos); siendo más utilizados los anti-inflamatorios no esteroideos, opioides débiles como el tramadol, bifosfonatos (ácido zalendrómico) y opioides fuertes como la morfina.17, 18 Sin embargo, para el control del dolor, solo en el 3% de los casos se hizo uso de opioides fuertes como la morfina inyectable (actualmente único opioide fuerte disponible en el sistema de salud público); resultados que son distintos a los reportados 17, 18, 19, 20 que reportan usos de morfina inyectada o subcutánea y oral (no disponible en el país) en el orden del 24% y 28% de los casos. Esto explica que en el contexto nacional el 97% de los pacientes oncológicos carece de accesibilidad a un opioide fuerte para el manejo y control de su dolor óseo metastásico; resultados que son semejantes a los reportados por la Junta Internacional de Fiscalización de Estupefacientes (JIFE)13 en su informe anual 2013, en donde reportan que países en vías de desarrollo el 99% de los pacientes oncológicos mueren sin tener acceso a un tratamiento adecuado del dolor, siendo este igual que el performance statu, un factor pronóstico de supervivencia. (tabla 2)
Las complicaciones agudas pos-RTP se presentaron en el 29% de los casos, similar a los reportados por 6 que reportan complicaciones agudas en el orden de 24%-35% de los casos. En cuanto a los estadios clínicos (EC) y su relación con MO postratamiento general, se observó que el estadio clínico III presentó un PLEOM de 22.1 meses (1,8 años), seguido del estadio clínico IV (8 meses), II (35,3 meses) y I (77,5 meses), con mediana de SV pos-RTP para todos los estadios clínicos de 13,5 meses. Aunque estos últimos resultados probablemente por el tipo de outcomes a medir versus muestra muy pequeña,21 en la razón de verosimilitudes de Chi cuadrado no fueron estadísticamente significativos (p > 0,1252 para α = 0,05), no obstante, estos resultados no deben ser desestimados a la hora del seguimiento de pacientes oncológicos y tener siempre presente la probabilidad que el 3% de los pacientes en EC: I, pueden presentar MO a los 77,5 meses (6,4 años) y el 53% de los EC:III a los 22,1 meses (1,8 años), con SV pos-RTP del 19,3 meses y 9,8 meses, respectivamente. (tabla 3 y 4)
Según el tumor primario, el PLEOM, fue más corto para el cáncer de riñón, pulmón y tiroides, asociadas con SV pos-RTP más cortas (3-9 meses), esto es atribuible a la agresividad y radioresistencia de dichas patologías oncológicas, que ya es muy bien conocida. No obstante, el PLEOM más largos fueron observados para el CaCu (46 meses), mama (37 meses) y próstata (30,7 meses), con SV pos-RTP de 23.4 meses (rango 12-31 meses), siendo estos resultados estadísticamente significativos y equiparables a los reportados en la literatura internacional. 1, 2, 3, 5, 6, 7 (tabla 4 y figura 3)
Al evaluar el PLEOM y SV pos-RTP, según el género, se evidenció que el PLEOM es más largo en el sexo femenino (mediana 39,4 meses), asociadas a SV más larga pos-RTP (18,6 meses) versus el masculino con 29,5 meses (PLEOM) y 8,5 meses (SV pos-RTP); resultados que son similares a los reportados.5, 7, 9, 10 En cuanto al rango de edad, se observó que el PLEOM es más corto en las edades extremas (menor a 24 años y mayor de 70 años), asociados a SV más cortas pos-RTP (mediana de 9 meses), que a diferencia del rango de edad de mayores de 25 años y menores de 70 años la medina de SV es de 13,5 meses; pero estos últimos resultados en la razón de verosimilitudes de Chi cuadrado no fueron estadísticamente significativos (p >0,1984 para α =0,05), a pesar de ser equiparables a los reportados,12, 13 en donde los mayores de 68 años con MO (tienen una SV menor a 5 meses / estudios de cohortes retrospectivas de 5 años) y los menores de 68 años (tienen una SV entre 10 a 19 meses).
En cuanto a la localización anatómica de la MO, resultados similares fueron obtenidos a los reportados10, 15 por el cual el número lesiones óseos y sitios metastásicos son un factor pronóstico en la supervivencia de los pacientes oncológicos (mediana de 4 meses). No obstante, al correlacionar sobrevida global versus dosis de RTP, se observó mayor sobrevida (26 meses) en pacientes a los cuales se les aplicó 8Gy en dosis única, seguida 23 meses (30 Gy en 10fx de 3Gy) y 20 meses (20Gy en 5fx de 4Gy). Estos resultados son atribuibles al tipo de población en estudio (edad avanzada, inadecuado manejo del dolor, tipo de patologías oncológicas, múltiples sitios metastásicos, anemia, IK menor al 60% y no protocolización del tratamiento), sin embargo, son estadísticamente significativos (p<0,0032 / p<0,0024 para α= 0,05) y similares a los reportados.7, 8, 10, 14 (figura 1 y 2)
Basados en la evidencia científica internacional y nacional en metástasis óseas; se recomienda al Centro Nacional de Radioterapia Nora Astorga (CNRNA) realizar un protocolo de manejo radioterapéutico paliativo con cobalto60 (único tipo de tecnología disponible en Nicaragua), tomando como directriz central que todo pacientes oncológicos con metástasis óseas única y IK mayor al 75%, la dosis de RTP recomendada es de 30 Gy (diez sesiones de 3 Gy c/u), en pacientes con metástasis ósea única, IK entre 50-75% se recomienda dosis total de 20 Gy (cinco sesiones de 4 Gy c/u) y en pacientes con múltiples metástasis óseas, IK menor al 50% se recomienda una dosis única de 8 Gy (medianas de sobrevida obtenidas en este estudio de 26 meses pos-RTP).
CONCLUSIONES
Se observó una mayor incidencia de casos en el sexo femenino, con una mediana de presentación de la enfermedad a los 51 años. Las patologías oncológicas más frecuentes que causaron MO fueron cáncer de mama, próstata, CaCu y pulmón; siendo el santuario predilecto de metástasis ósea la columna dorso-lumbar, pelvis y miembros inferiores. La RTP más utilizada fue la planificación 2D con esquema hipo fraccionado de 8Gy en dosis única; siendo la radio dermitis (actinitis) y la enteritis grado I y II las complicaciones agudas más comunes. La sobrevida libre de enfermedad ósea metastásica, según el tumor primario, género y localización anatómica es de aproximadamente 31 meses (estadísticamente significativos); siendo la sobrevida global de estos pacientes pos-RTP del 63% a los 13,5 meses, con una sobrevida acumulada a 5 años, según el método actuarial del 9% (vivos al final del estudio).
REFERENCIAS BIBLIOGRÁFICAS
- National Comprehensive Cancer Network (NCCN), Bone, Guidelines Version 1.2017.
- National Comprehensive Cancer Network (NCCN), Palliative Care, Guidelines Version 1.2017.
- Hansen E M.D, et al. Handbook of Evidence-Based Radiation Oncology 2010. 2nd Edition. Capítulo # 42. Palliation. p680.
- Howell DD, et al. Randomized Trial of Short-Course versus Long-Course Radiotherapy for Palliation of Painful Vertebral Bone Metastases: A Retrospective Analysis of RTOG 97-14. J Clin Oncol 2009; 27:7s.
- Svensson E, et al. Survival after bone metastasis by primary cancer type: a Danish population-based cohort study, BMJ Open 2017; doi:10.1136 / bmjopen.
- Lutz S M.D, et al. Palliative radiotherapy for bone metastases: an ASTRO evidence-based guideline. J. Radiation Oncology Biol. Phys. 2011, Vol. 79, (4); pp. 965–976. doi:10.1016/j.ijrobp.2010.11.026
- Chow E, Harris K, et al. Palliative Radiotherapy Trials for Bone Metastases: a Systematic Review. J Clin Oncol 2007; 25:14231436.
- Ibrahim T, Mercatali L, Amadori D. Bone and cancer: the osteoncology. Clin Cases Miner Bone Metab 2013; 10:121–3.
- Brodowicz T, O'Byrne K, Manegold C. Bone matters in lung cancer. Ann Oncol 2012; 23:2215–22.
- Coleman RE. Metastatic bone disease: clinical features, pathophysiology and treatment strategies. Cancer Treat 2001; 27: 165–176.
- Coleman RE. Clinical features of metastatic bone disease and risk of skeletal morbidity. Clin Cancer Res 2006; 12:6243s–9.
- Yong M, Jensen AÖ, Jacobsen JB, et al. Survival in breast cancer patients with bone metastases and skeletal-related events: a population-based cohort study in Denmark (1999-2007). Breast Cancer Res Treat 2011; 129:495–503.
- Drzymalski DM, Oh WK, Werner L, et al. Predictors of survival in patients with prostate cancer and spinal metastasis. Presented at the 2009 Joint Spine Section Meeting. Clinical article. J Neurosurg Spine 2010; 13:789–94.
- Yuasa T, Urakami S, Yamamoto S, et al. Treatment outcome and prognostic factors in renal cell cancer patients with bone metastasis. Clin Exp Metastasis 2011; 28:405–11.
- Gottwald L, Dukowicz A, Piekarski J, et al. Bone metastases from gynaecological epithelial cancers. J Obstet Gynaecol 2012; 32:81–6.
- Lobos M, et al. Sobrevida de pacientes con cáncer de mama y metástasis ósea. Chil Cir. Vol. 65 (6); Diciembre 2013; pág. 489-494.
- Berterame S, et al. Use of and barriers to access to opioid analgesics: a worldwide, regional, and national study. Lancet 2016; 387: 1644–56.
- International Narcotics Control Board (INCB). Statistical information on narcotic drugs 2012. Estimated World Requirements for 2012 and Statistics for 2010.1 / 187
- Junta Internacional de Fiscalización de Estupefacientes (JIFE). Naciones Unidas. Informe 2012. (E/INCB/2012/1).
- Palacios C, et al. Consumo de opioides en el Instituto Nacional de Cancerología, México (INCAN) 2012. Trabajo de Investigación Clínica.
- Ferreira I, et al. Problems with use of composite endpoints in cardiovascular trials: systematic review of randomised controlled trials. BMJ 2007. doi: 10.1136/bmj.39136.682083.AE.
- Pedroza P, M.E. y Dicovskiy R., L.M. Sistema de Análisis Estadístico, con SPSS. Primera Edición. INTA / IICA. 2006.139 p.
- Ministerio de Salud de Nicaragua, Registro del Cáncer del Centro Nacional de Radioterapia “Nora Astorga”, (REGCAN4-CNR), 2017.
