

Luis Giovanni Rosales Pichardo1, Miriam Deyanira Rodríguez Piña2,
Lissette Larissa Suarez Valencia3, Hugo Mendieta Zerón 4
1 https://orcid.org/0000-0001-9435-9126, 2 https://orcid.org/0000-0003-1882-2814,
3 https://orcid.org/0000-0002-6400-0179, 4 https://orcid.org/0000-0003-3492-8950
1-4 Facultad de Medicina, Universidad Autónoma del Estado de México (UAEMex)
4 Hospital Materno Perinatal Mónica Pretelini Saénz (HMPMPS), Instituto de Salud del Estado de México (ISEM)
Actualmente el estándar de oro para el diagnóstico de la infección por SARS-CoV-2 es la RT-PCR (transcriptasa inversa PCR). Además de su función diagnóstica, es un indicador indirecto de la carga viral que tiene un paciente. Nuestro conocimiento de este nuevo virus nos indica que una carga viral alta se asocia con un peor pronóstico y un cuadro clínico más severo. Por tanto, el lograr una disminución en dicha carga puede mejorar el pronóstico de los pacientes. Con este objetivo, la nitazoxanida es una alternativa terapéutica que tiene el potencial de reducir la carga viral. Se realizó un estudio observacional retrospectivo donde al inicio del mismo se realizó una qPCR (PCR en tiempo real) de control para posteriormente administrar a los participantes 500 mg de nitazoxanida cada seis horas por 7 días, después se repitió la qPCR. Los resultados fueron contrastados y analizados observándose un resultado negativo en un 55.55 % de los participantes, quedando pendiente determinar molecularmente con conteos virales el porcentaje real de la nitazoxanida para la seronegatividad de la prueba.
Palabras clave: COVID-19, nitazoxanida, qPCR, SARS-CoV-2.
Currently, the gold standard for the diagnosis of SARS-CoV-2 infection is RT-PCR (reverse transcriptase PCR). In addition to its diagnostic function, it is an indirect indicator of the viral load that a patient has. Our knowledge of this new virus indicates that a high viral load is associated with a worse prognosis and a more severe clinical picture. Therefore, achieving a decrease in said load can improve the prognosis of patients. To this end, nitazoxanide is a therapeutic alternative that has the potential to reduce viral load. A retrospective observational study was carried out where, at the beginning of the study, a control qPCR (real-time PCR) was performed to later administer 500 mg of nitazoxanide to the participants every six hours for 7 days, after which the qPCR was repeated. The results were contrasted and analyzed, observing a negative result in 55.55% of the participants, it remains to determine molecularly with viral counts the real percentage of nitazoxanide for the seronegativity of the test.
Key words: COVID-19, nitazoxanide, qPCR, SARS-CoV-2.
El diagnóstico de sospecha de la COVID-19 se basa en criterios clínicos, es decir, signos y síntomas que el médico tratante puede observar y que son consistentes con la historia natural de esta enfermedad, mientras que el diagnóstico de certeza se consigue cuando se logra evidenciar la presencia del virus, ya sea por la identificación de componentes del agente causal (por ejemplo, mediante un estudio de RT-PCR) o bien, al manifestar la respuesta inmunológica del hospedador (como en el caso de las pruebas de anticuerpos).
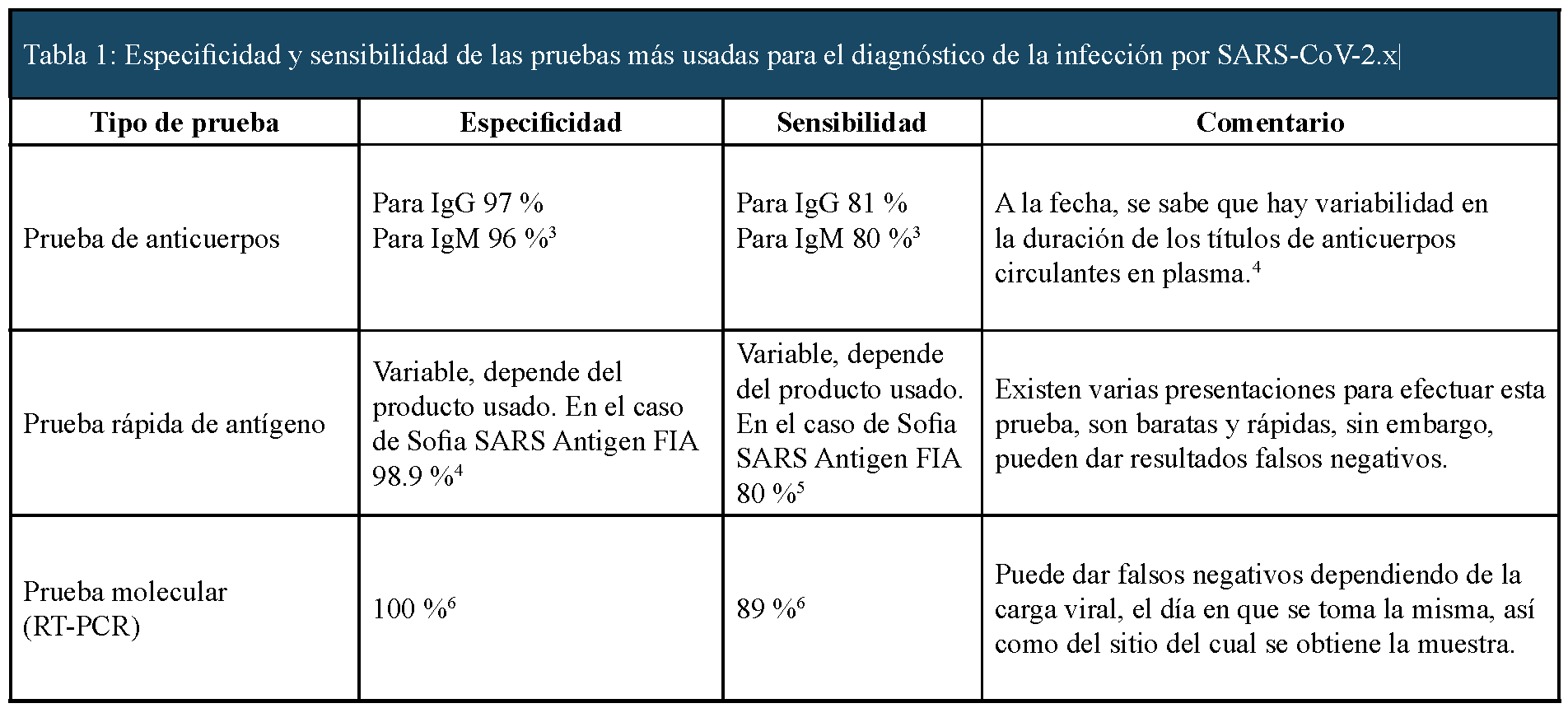
La Tabla 1 compara la efectividad de diversas pruebas de laboratorio para detectar una infección por SARS-CoV-2, sin embargo, el gold standard es la RT-PCR (reacción en cadena de la polimerasa transcriptasa inversa, por sus siglas en inglés). Esta prueba es una variante de la PCR y consiste en una combinación entre el proceso de transcripción inversa del RNA en DNA (denominado DNA complementario o DNAc) y la amplificación de dicho DNA mediante PCR,1 utilizándose principalmente para medir la cantidad de un RNA específico.
Otro estudio utilizado con una especificidad y sensibilidad semejante es la PCR en tiempo real (qPCR), siendo una variante de la PCR convencional y que se utiliza para amplificar y cuantificar de forma absoluta el producto de la amplificación del DNA. Para ello emplea una metodología semejante al de una PCR pero añadiendo una sustancia marcada con un fluoróforo que permita medir la tasa de generación de uno o más productos específicos.2
El SARS-CoV-2 es el agente causal de la enfermedad llamada COVID-19. Es un virus complejo de cerca de 30 kbp cuyas principales proteínas son las siguientes: en su envoltura externa encontramos las proteínas estructurales principales, las cuales son la proteína Spike (S), la proteína de membrana (M) y la proteína de envoltura (E), además, de proteínas accesorias. En la nucleocápside se encuentra la proteína N (de la nucleocápside).6 Las principales funciones de estas proteínas son las siguientes: la proteína (S) facilita la unión del virus al receptor de la célula huésped, la proteína (M) ayuda a mantener la curvatura de la membrana y la unión con la nucleocápside, la proteína (E) juega un papel importante en el ensamblaje y liberación del virus y la proteína (N) forma parte de la nucleocápside al unirse al material genético viral. Es interesante destacar el papel preponderante de la proteína S, pues es la responsable de generar la interacción del virus con los receptores de la enzima convertidora de angiotensina tipo 2 (ACE2), un paso crucial en la patogenia de la infección por parte de este coronavirus.7,8
Una vez que el virus logra ingresar al hospedador, comienza su proceso de replicación para posteriormente dar origen al cuadro clínico conocido como COVID-19, donde sus tres principales manifestaciones serán la cefalea, la tos y la fiebre mayor a 38°C, y como síntomas secundarios: la disnea (vinculado a una mayor severidad de la enfermedad), artralgias, mialgias, anosmia (síntoma precoz), rinorrea, conjuntivitis, odinofagia y dolor de pecho.9
En el caso de la COVID-19, la prueba se basa en la detección del RNA viral, mediante la obtención de muestras de esputo, lavado broncoalveolar e hisopado nasal, y a través de la RT-PCR se amplifican las secuencias ORF 1ab (open reading frame) y fragmentos de la proteína de la nucleocápside; el fragmento seleccionado para la prueba varía de acuerdo al estudio y país. Por ejemplo, los mencionados previamente fueron empleados por los Centers for Disease Control and Prevention (CDC) en China mientras que los CDC en Estados Unidos emplearon tres regiones del gen N.
De acuerdo con la OMS la detección del gen de la proteína E (Envoltura) se emplea como prueba confirmatoria de primera elección, seguida de la expresión del gen RdRp (RNA dependiente de la RNA polimerasa). De aquí se obtiene que existen dos vertientes para detectar la infección por SARS-CoV-2, la empleada por la OMS y la efectuada por los CDC.10
La evidencia acumulada sugiere que la carga viral del SARS-CoV-2 guarda una importante relación con la infectividad, el fenotipo de la enfermedad, así como la morbilidad y la mortalidad.11 También existen datos que sugieren que una mayor carga viral implica una mayor severidad de la enfermedad.12,13 Considerando todo lo anteriormente expuesto, es factible razonar que el uso de medicamentos con la capacidad de reducir la carga viral, tendrán un efecto importante en el pronóstico de los pacientes afectados por la COVID-19.
La nitazoxanida es una benzamida sintética, que durante mucho tiempo se ha utilizado como antiparasitario. Químicamente, es derivado del 5-nitrotiazol y ejerce su mecanismo de acción al interferir en la reacción de transferencia de electrones dependiente del piruvato de ferredoxina/flavodoxina oxidorreductasa logrando interrumpir el metabolismo del parásito mientras que en los helmintos impide la polimerización de la tubulina.14 En el cuerpo, es rápidamente degradada a tizoxanida (su metabolito activo) teniendo una vida media muy corta en plasma, cercana a los 6 minutos siendo su principal vía de eliminación la fecal y en una menor proporción, la vía renal.15
La experiencia con este fármaco y diversos virus ha sido estudiada desde hace tiempo atrás. Por ejemplo, en 2015, cuando la epidemia por el virus del Ébola estuvo en su auge, la Food and Drug Administration (FDA) autorizó su uso contra este patógeno al observar que in vitro inhibe la replicación del virus además de amplificar la respuesta inmunológica del hospedador contra el virus por varios mecanismos.16
También, es importante señalar que la nitazoxanida fue ampliamente señalada como un agente potencial para tratar el síndrome de dificultad respiratoria del Medio Oriente, causado por el coronavirus MERS.17 En este punto es fundamental destacar las similitudes genómicas que presentan el MERS y el SARS-Cov-2,18 por lo que tratamientos que han sido efectivos contra esta patología podrían ser usados para la COVID-19.
Recientemente, este medicamento ha recibido un nuevo enfoque como un potencial agente terapéutico en los pacientes infectados por SARS-CoV-2. Un estudio dirigido en México en el año 2020, indica que los pacientes tratados con este antiparasitario presentan una mejora clínica y que la nitazoxanida podría ser útil contra la COVID-19 como un régimen seguro y disponible para ser probado de manera masiva e inmediata.19 Además, un estudio randomizado ha incluido este fármaco (junto a la hidroxicloroquina) con la finalidad de reducir la necesidad de intubar a los pacientes y tenerlos con soporte mecánico ventilatorio.20
A la luz de la evidencia expuesta, el siguiente enfoque lógico para dicho fármaco es determinar si su administración en pacientes enfermos a causa del SARS-CoV-2 logra volver negativa la prueba de RT-PCR y de esta forma, analizar el grado de éxito del tratamiento con nitazoxanida en pacientes diagnosticados con COVID-19. El objetivo del presente estudio fue determinar el porcentaje de seronegatividad a la prueba de qPCR en pacientes con COVID-19 tratados con nitazoxanida después de una semana de manejo.
Se efectuó un estudio observacional, retrospectivo en el Hospital Materno Perinatal “Mónica Pretelini Saenz” (HMPMPS), del Instituto de Salud del Estado de México (ISEM), Toluca, México, con pacientes atendidos por síntomas de COVID-19 durante los meses de mayo a julio del año 2020, quienes fueron sometidos a la siguiente secuencia de atención:
Se contó con los siguientes criterios de inclusión: pacientes mayores de 18 años de edad, pacientes con sintomatología consistente para COVID-19 y qPCR positiva. Los criterios de exclusión fueron: qPCR negativa, pacientes con antecedentes de alergia a la nitazoxanida o compuestos semejantes. Los criterios de eliminación fueron: cuando se perdiera el seguimiento clínico, alta hospitalaria antes de efectuar la segunda qPCR. No se clasificó la severidad del cuadro inicial.
Este proyecto fue autorizado por el Comité de Ética en Investigación del HMPMPS (registro: 2021-04-724) y se consideró sin riesgo al tratarse de una revisión de expedientes que no requirió consentimiento informado. La información obtenida fue capturada en una base de datos de Excel en español 2013. La codificación y el análisis de los datos se hizo utilizando el Programa Excel en español 2013.
Se incluyeron un total de 45 expedientes, de los cuales (33) el 73,33 % pertenecen al sexo femenino mientras que (12) el 26,67 % al sexo masculino. Los expedientes analizados en este estudio se captaron en consulta privada y consulta externa del HMPMPS. La edad promedio de los pacientes fue de 34.9 años, mientras que para las mujeres participantes fue de 32.9 y para los hombres fue 40.4 años. Todos los pacientes dieron positivo para infección por SARS-CoV-2 mediante la toma de una qPCR, a los cuales se les inició tratamiento con nitazoxanida a razón de 500 mg cada seis horas durante una semana para posteriormente tomar una qPCR de control.
Del qPCR control se obtuvo los siguientes resultados, un total de (25) pruebas negativas, lo que representa un 55,55 % de la población estudiada y (20) positivas, que representan el 44,45 % de los participantes. De las 20 pruebas positivas, (13) pertenecieron a mujeres 70 %, mientras que (6) fueron de los hombres 30 %. Por otro lado, de las 25 pruebas negativas, (6) pertenecieron al sexo masculino 24 % y (19) al femenino 76 %. Aunque el tamaño muestral no es suficiente para corroborar una tendencia estadística irrefutable, estos datos sugieren que la nitazoxanida tiene el potencial de volver negativa la prueba de qPCR en los pacientes infectados por SARS-CoV-2.
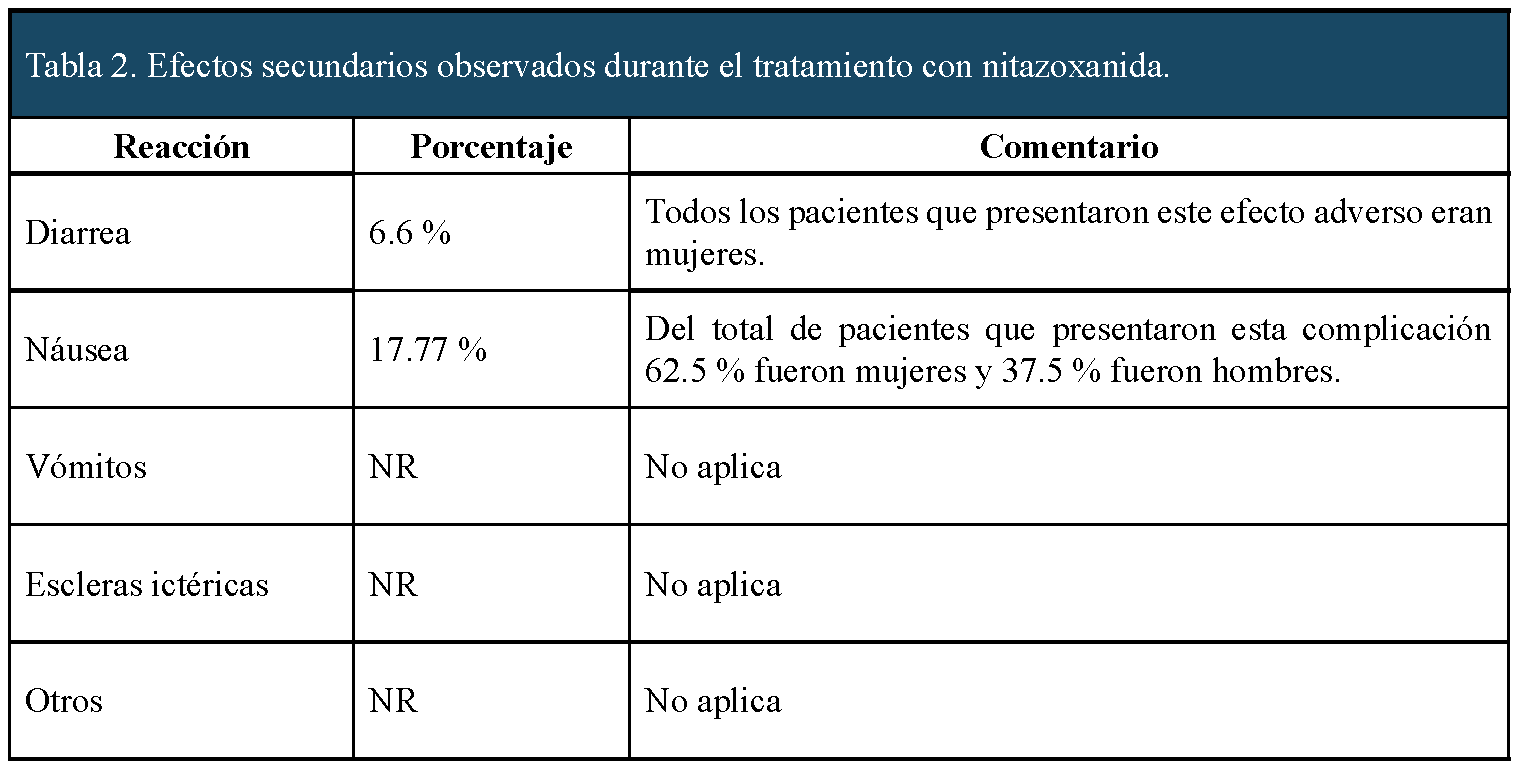
Un total de (11) 24,44 % pacientes manifestaron efectos adversos con el tratamiento con nitazoxanida, siendo el más frecuente de ellos la náusea. Es interesante señalar que la mayoría de estos efectos se observaron en mujeres (el 72,72 % de la población que refirió efectos adversos). Los efectos secundarios o reacciones adversas vinculadas al tratamiento con nitazoxanida se resumen en la tabla 2.
Conocemos que la actual pandemia ha dejado numerosas lecciones para el área médica, quedando patente la necesidad de la investigación. Respecto a este punto, se evidencia que en todo el mundo se están buscando diariamente alternativas para tratar la COVID-19. No obstante, a pesar de que actualmente diversas guías se han publicado sobre el manejo del paciente infectado por SARS-CoV-2 y aunque muchos tratamientos y manejos se han sugerido, en un porcentaje menor se cuantifica la carga viral.
Previamente hemos externado el papel preponderante de la carga viral en la severidad de la enfermedad y por qué sería importante lograr una disminución de esta. En este contexto, nuestra investigación sugiere que el uso de la nitaxozanida puede contribuir a la reducción de la carga viral en poco más del 50 % de los involucrados. También debemos señalar que, durante el seguimiento clínico, dos de los pacientes involucrados seguían presentando una qPCR positiva hasta un mes después de instaurado el tratamiento.
Basados en nuestra experiencia, sugerimos que se continúe la investigación del efecto de la nitazoxanida con una mayor cantidad de participantes o que a partir de la base de datos de las instituciones de salud pública se pueda extraer información para determinar el período en que están resultando negativas las pruebas diagnósticas de los pacientes en relación con el tratamiento implementado, ya que al hacer esto se estará teniendo una mejor base analítica para comparar dichos tratamientos.
Actualmente existen varias opciones terapéuticas cuya efectividad aún está siendo estudiada. Como bien sabemos, en este contexto de la pandemia se han propuesto diversos esquemas de tratamiento, cada uno de ellos con sus puntos a favor y en contra por lo que un conocimiento de estos permitirá diseñar mejores esquemas terapéuticos para los pacientes con la COVID-19.21
En este aspecto, la información sobre la efectividad de esta terapia es, en muchos casos, contradictoria. Mientras varios estudios han señalado cierto grado de efectividad.22,23,24 e incluso el hecho de que la FDA ha aprobado su uso de emergencia25 otros estudios señalan que no tiene un efecto estadísticamente significativo sobre la mortalidad26 y que incluso, pudiera asociarse al desarrollo de mutaciones en el SARS-CoV-2 (bajo circunstancias específicas).27
Al efectuar esta investigación la principal dificultad que se tuvo fue el tamaño de la muestra, que fue relativamente pequeña, debido a que al momento de captar a los pacientes las pruebas de PCR estaban limitadas para confirmar el diagnóstico, pero no para el seguimiento. Otra limitante es que no se obtuvo la cuantificación de la carga viral, tan solo la respuesta cualitativa como positiva o negativa, por lo que hay que tomar con cautela la posible negativización de la qPCR con el uso de la nitazoxanida. Finalmente, este estudio no clasificó la gravedad de los pacientes, aunque en todo caso se empezó el manejo ante el inicio de los primeros síntomas.
Al ser un estudio retrospectivo, se requiere el diseño de un protocolo de investigación aleatorizado doble ciego, con un incremento en la muestra de pacientes, para validar las conclusiones que aquí se presentan. También es de vital importancia otorgar un seguimiento estricto a los participantes y definir la posible existencia de sesgos y eliminarlos.
Sugerimos a las instituciones de salud que implementen estudios comparativos, donde se pueda determinar el tiempo transcurrido entre que los pacientes fueron detectados positivos mediante una qPCR, la instauración del tratamiento y el momento en que la qPCR de dichos pacientes resultó seronegativa, ya que esto nos permitirá conocer la eficiencia y eficacia que están teniendo los tratamientos contra la COVID-19.
Con fundamento en lo anteriormente expuesto llegamos a la conclusión de que la nitazoxanida a razón de 500 mg cada 6 horas durante un período de 7 días, puede ser una alternativa terapéutica en el contexto de la COVID-19, pero no se puede precisar qué tanto influye su uso en el porcentaje de seronegatividad de una prueba de qPCR que identifica esta enfermedad.
Los autores agradecen a los asistentes del Taller de Escritura y Redacción de Artículos Científicos de la Asociación Científica Latina A.C. (ASCILA), por sus sugerencias para mejorar el manuscrito.
Los autores manifiestan no tener conflictos de ningún tipo.