

Luis García Valle1, María J. Ayerdis2, José Luis Giroud3, Jorge Martínez Cerrato4, Gerardo Ali Reyes5.
1 Hospital Militar Escuela Dr. Alejandro Dávila Bolaños, Centro de Neurociencias Hospital Vivian Pellas, Managua, Nicaragua.
2Hospital Bautista, Managua, Nicaragua, 3Hospital Salud Integral, Managua, Nicaragua.
, 4Hospital Vivian Pellas, Managua, Nicaragua, 5Hospital Bautista, Hospital Vivian Pellas, Managua, Nicaragua,
1luisneuro2009@gmail.com, https://orcid.org/0009-0005-9233-006X , 2mjayerdis@hotmail.com, https://orcid.org/0000-0003-2321-6827 ,
3jlgiroud@gmail.com, https://orcid.org/0000-0001-6200-3045 , 4jamc.neurologia@gmail.com, https://orcid.org/0000-0002-8795-4506 ,
5gargneurol@yahoo.com, https://orcid.org/0000-0002-4667-1446 ,
Autor por correspondencia: Dr. Luis García Valle, luisgavalle@yahoo.es, luisneuro2009@gmail.com ,
Introducción: La definición de falla al tratamiento en Esclerosis Múltiple (EM), constituye un aspecto central de la asistencia de pacientes, ya que su rápida identificación y abordaje permitirá evitar la progresión de la enfermedad en los pacientes afectados. El objetivo del siguiente consenso es de proveer recomendaciones sobre la identificación de la falla al tratamiento en pacientes con EM fenotipo recaída-remisión (RR) en Nicaragua.
Métodos: Ronda de encuesta a distancia, realizada por un grupo de 5 neurólogos de Nicaragua a través de un Link que permitió acceder al formulario para contestar las afirmaciones, siendo el grado de acuerdo en base a su conocimiento, experiencia y a la bibliografía adicional enviada para su revisión. Las afirmaciones se realizaron en tres secciones: 1) Aspectos generales del seguimiento de pacientes con esclerosis múltiple e identificación de la actividad de la enfermedad. 2) Importancia de la identificación de la actividad de la EM y 3) Definición de falla al tratamiento. La puntuación de cada afirmación fue establecida en las siguientes categorías: inapropiada, dudosa y apropiada.
Resultados: Se realizaron un total de 59 afirmaciones, las que fueron divididas en tres secciones; primera con 28 afirmaciones, segunda con 20 afirmaciones y tercera con 11 afirmaciones. Del total de las afirmaciones 40 (67.7%) obtuvieron categoría de respuesta apropiada, 17 (28.8%) respuesta dudosa y 2 (3.38%) inapropiada.
Conclusión: Se establecieron las recomendaciones basadas en la evidencia publicada y en el criterio de los expertos que participaron. Las recomendaciones abordan aspectos generales del manejo, así como la definición en pacientes utilizando terapias de forma sostenida (mantenimiento) como pulso terapias (terapias de reconstitución) en pacientes con EMRR. Aunque no hay una definición universalmente aceptada de falla al tratamiento, el contar con recomendaciones locales, nos permitirá optimizar el cuidado de los pacientes en nuestro medio. Estas recomendaciones buscan ayudar al neurólogo en el seguimiento de pacientes con EMRR que no responden a los tratamientos implementados.
Palabras clave: Esclerosis múltiple, falla al tratamiento, consenso, Nicaragua
Introduction: The definition of treatment failure in Multiple Sclerosis (MS) is a central aspect of patient care, since its rapid identification and approach will prevent the progression of the disease in affected patients. The objective of the following consensus is to provide recommendations on the identification of treatment failure in patients with relapsing-remitting (RR) MS phenotype in Nicaragua.
Methods: Remote survey round, carried out by a group of 5 Nicaraguan neurologists through a link that allowed access to the form to answer the statements, the degree of agreement being based on their knowledge, experience and the additional bibliography sent for your review. The assertions were made in three sections: 1) General aspects of the follow-up of patients with multiple sclerosis and identification of disease activity. 2) Importance of identifying MS activity and 3) Definition of treatment failure. The score of each statement was established in the following categories: inappropriate, doubtful and appropriate.
Results: A total of 59 statements were made, which were divided into three sections; first with 28 affirmations, second with 20 affirmations and third with 11 affirmations. Of the total number of statements, 40 (67.7%) obtained the appropriate response category, 17 (28.8%) doubtful response, and 2 (3.38%) inappropriate.
Conclusion: The recommendations were established based on the published evidence and the criteria of the experts who participated. The recommendations address general aspects of management, as well as the definition of patients using sustained therapies (maintenance) such as pulse therapies (reconstitution therapies) in patients with RRMS. Although there is no universally accepted definition of treatment failure, having local recommendations will allow us to optimize patient care in our setting. These recommendations seek to help the neurologist in the follow-up of patients with RRMS who do not respond to the implemented treatments.
Key words: Multiple sclerosis, treatment failure, consensus, Nicaragua
La esclerosis múltiple (EM) es una enfermedad crónica degenerativa de etiología autoinmune que afecta preferentemente adultos jóvenes entre los 18 y 45 años 1-3.
Las Terapias Modificadoras de la Enfermedad (TME) para la EM, actuando ya sea a través de la modulación o la supresión del sistema inmunitario, han modificado la historia de la enfermedad a través de diversos mecanismos de acción 4-6. Algunas de estas terapias se proveen de forma sostenida en el tiempo, mientras que otras son utilizadas en ciclos de tratamiento buscando reconstituir el sistema inmune 4,6-8. Independientemente de si son usadas de forma sostenida o en ciclos, el objetivo de las TME es evitar la progresión irreversible de la enfermedad en los pacientes afectados 4,6-11.
En la actualidad, uno de los principales retos de la práctica clínica junto con la individualización del tratamiento en base a la agresividad de la enfermedad, es la identificación de la falla al tratamiento iniciado de forma precoz con el objetivo de rápidamente modificar el mismo y aprovechar la ventana terapéutica en los pacientes afectados 4,5,12. En consecuencia, uno de los mayores desafíos es la definición de respuesta/fracaso al tratamiento para optimizar las decisiones de tratamiento 13-16. Actualmente, existen algunos sistemas de puntuación que permiten a los médicos identificar la falla al tratamiento 12-18; sin embargo, dichos sistemas no han sido consensuados en nuestro medio 12-18.
El objetivo de este consenso fue revisar cómo se debe evaluar la actividad de la enfermedad y proponer recomendaciones sobre la identificación de la falla al tratamiento en pacientes con EM fenotipo recaída-remisión (RR) en Nicaragua.
Un panel de 5 especialistas en neurología de Nicaragua, orientados al cuidado de pacientes con EM, se reunió durante 2021 y 2022 en diversas oportunidades vía virtual para lograr consenso de afirmaciones y emitir recomendaciones sobre la identificación de la falla al tratamiento en pacientes con Esclerosis Múltiple Recaída Remisión (EMRR).
La selección de los expertos se basó en su experiencia y en la cantidad de pacientes con seguimiento de la enfermedad (al menos 12 años en la práctica de la neurología y con seguimiento de al menos 30 pacientes con EM por año). Para concretar el consenso se envió un Link que permite acceder al formulario para contestar las afirmaciones, siendo el grado de acuerdo en base a su conocimiento, experiencia y bibliografía adicional enviada para su revisión. Las afirmaciones se realizan en tres secciones: 1) Aspectos generales del seguimiento de pacientes con esclerosis múltiple e identificación de la actividad de la enfermedad, 2) Importancia de la identificación de la actividad de la EM y 3) Definición de falla al tratamiento. La puntuación sobre cada afirmación fue otorgada en las siguientes categorías: inapropiada, dudosa y apropiada. 19,20. Previo a la consulta de los escenarios con los expertos se realizó una revisión sistemática y síntesis de la literatura sin restricción de idioma en MEDLINE, EMBASE y LILACS para el período 1990-2021. Los términos de búsqueda fueron "esclerosis múltiple", con los modificadores "tratamiento", "respuesta subóptima", "fracaso", "optimización" y "respuesta". Los documentos clínicos relevantes fueron 50 artículos científicos, los que se distribuyeron al grupo de trabajo para su revisión y que pudieran responder a las propuestas y recomendaciones de la discusión (Fig. 1). Posteriormente se generaron los escenarios de afirmaciones y se consultó sobre el grado de acuerdo de cada experto con una determinada afirmación relacionada al monitoreo de la actividad de la enfermedad y la definición del grado de actividad que constituía la falla al tratamiento en curso. Operativamente, se realizaron tres rondas virtuales para la evaluación, por parte de cada profesional de las afirmaciones generadas. Una vez que se generó el consenso sobre las afirmaciones, se realizó una cuarta ronda virtual de consenso general y revisión final de éstas. Durante el proceso, cada experto tuvo a disposición la bibliografía para su consulta. En cada ronda virtual, se indaga sobre el grado de acuerdo de cada participante con una determinada afirmación. Se recibió, de cada uno, la respuesta en las distintas instancias del trabajo y se vio el grado de acuerdo general, así como también se evaluaron las observaciones generadas. Se realizaron un total de 59 afirmaciones. Cada afirmación fue posteriormente analizada de forma global. Se definió como apropiado cuando el 70% de los encuestados responden de forma similar, dudoso cuando es entre el 40 y 70%, e inapropiado menos del 40%. Tras el consenso de las 59 afirmaciones, se avanzó con la redacción del manuscrito, el cuál fue posteriormente circulado entre los autores para su acuerdo final y comunicación.
Se obtuvo un total de 59 afirmaciones a las tres rondas de preguntas realizadas, las que fueron divididas en tres secciones; primera con 28 afirmaciones, segunda con 20 afirmaciones y tercera con 11 afirmaciones. Del total de las afirmaciones 40 (67.7%) obtuvieron categoría de respuesta apropiada, 17 (28.8%) respuesta dudosa y 2 (3.38%) inapropiada.
Antes de avanzar con las recomendaciones respecto a la definición de falla al tratamiento, el grupo estableció algunas sugerencias generales respecto al manejo del paciente con EM. Principalmente lo relacionado con el seguimiento clínico y radiológico, previamente consensuado por grupos internacionales y adoptados por los distintos grupos de trabajos a nivel mundial. Está claro que las recaídas son la expresión clínica de la actividad y generan como consecuencia destrucción tisular focal responsable de la desmielinización perivascular y daño axonal en el Sistema Nervioso Central (SNC) 21. Las recaídas en consecuencia son importantes, no solo por la acumulación de discapacidad, cuando la recuperación es incompleta, sino porque es un claro indicador de persistencia de la actividad inflamatoria de la enfermedad 22. Por lo anterior, es importante llevar adelante un monitoreo clínico estrecho 4,12. En la actualidad, la Resonancia Magnética (RM) tiene un rol central a partir del uso de las técnicas convencionales (T2-FLAIR, T2, T1 y T1 con contraste) en el manejo de pacientes con EM. Se recomienda, en consecuencia, realizar una resonancia magnética cerebral a partir de los 6 meses de iniciado el tratamiento, con el objetivo de que esa RM permita un recuento basal de lesiones en T2 y la comparación posterior con las sucesivas RM. En caso en que el efecto del tratamiento comenzara más allá de este período, así como en pacientes en los que deben completar esquemas de tratamiento para conseguir el efecto completo, la RM basal debiera hacerse más allá de los 6 meses de su inicio (9-12 meses), aunque en el grupo de pacientes recibiendo terapias que deben completar esquemas (terapias de reconstitución) no está claro el momento en el que debiera hacerse la RM basal durante el seguimiento 23,24. Es importante remarcar que esta RM sería considerada la basal del paciente, evitando malinterpretar como respuesta subterapéutica, cambios que sucedieran durante el período en que el medicamento indicado no haya comenzado su acción. En aquellos pacientes más activos, con más recaídas o en los que se observan más lesiones en la resonancia. puede considerarse la realización de controles más frecuentes durante el seguimiento 17,24.
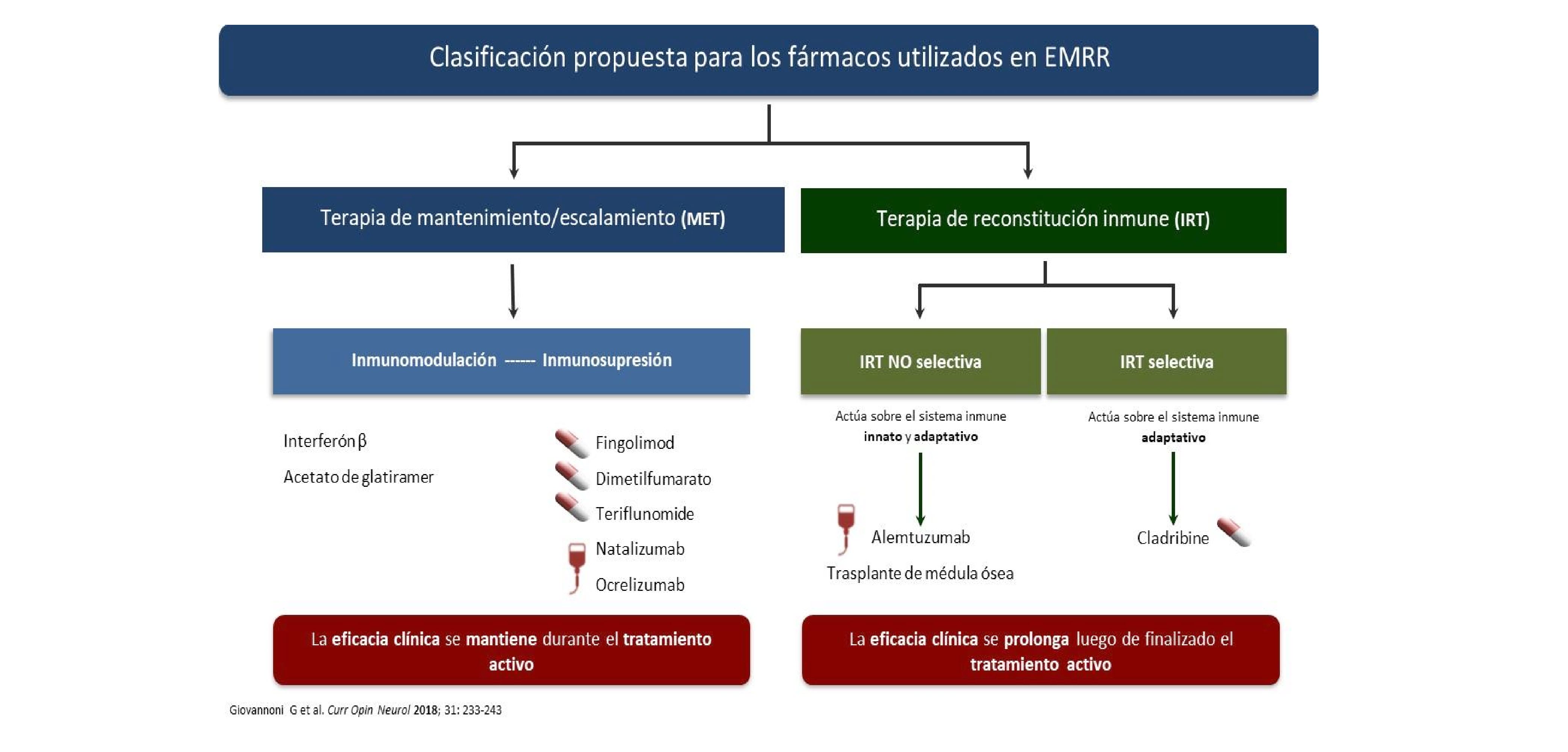
Un aspecto relevante en el contexto actual de terapias es contar con tratamientos que buscan reconstituir el sistema inmune y que se utilizan en ciclos de tratamiento y no de manera continua, tales es el caso de cladribina y alemtuzumab (Figura 2). Esto es importante, ya que se recomienda que los pacientes que inician estas terapias completen el esquema de tratamiento, tanto el año 1 y 2 para cladribina como para alemtuzumab respectivamente y se espere un tiempo prudencial de al menos 6 a 12 meses, tras haber completado el tratamiento y haber conseguido la reconstitución inmune y el efecto del tratamiento previo a definir una falla en caso de que persista la actividad clínica y/o radiológica 4,6. Es importante también, antes de definir una falla en pacientes que se encuentren usando estos tratamientos, determinar la magnitud de la actividad respecto a la etapa previo al inicio del tratamiento, ya que en el caso de encontrar una reducción significativa de las recaídas y/o lesiones en la resonancia respecto a la etapa anterior, existe la posibilidad de estar ante la presencia de actividad residual que debe ser tenida en cuenta como tal y no como una falla 25.
Recomendaciones generales de cuidado del paciente con EM
Terapias de mantenimiento
Las recaídas, las lesiones en la RM y la progresión en el EDSS han sido los factores principalmente evaluados como determinantes de persistencia de actividad en el tiempo en pacientes con EMRR. Sormani y col. en un estudio multicéntrico que incluyó 1280 pacientes con EMRR proveniente de 9 centros de la red MAGNIMS demostraron que la presencia de 2 o más recaídas durante el primer año de tratamiento incrementa el riesgo de falla al tratamiento durante los tres años siguientes (48%, HR 3.81, p=0.001) 26. Las recaídas fueron el primer factor ingresado al modelo en ese análisis, siendo responsable de explicar el 66% del fenómeno de falla, mientras que la presencia de nuevas lesiones en la secuencia T2 fue responsable en un 34%, mostrando la relevancia de la presencia de recaídas en la determinación de la falla en la práctica clínica 26. Es importante mencionar que la severidad y el tiempo de recuperación también tienen una importancia clínica 27. Los pacientes con mala recuperación o una recuperación pobre tienen más probabilidad de acumular discapacidad de forma más acelerada que aquellos pacientes en los que se observa una buena recuperación en las primeras recaídas 28. Algo similar ocurre desde la RM 29. Rio y col demostraron que ≥1 nueva lesión en el T2 o en la secuencia contrastada con gadolinio después del año de terapia con IFNβ se asocia con un incremento del riesgo de falla al tratamiento durante el seguimiento 14,15. Dobson et al. en una revisión sistemática mostró que la actividad de la enfermedad durante los primeros 6 a 24 meses de tratamiento con IFNβ definida por 2 o más nuevas lesiones en la secuencia T2 o la secuencia T1 con contraste, predijo la falla al tratamiento y la progresión de la discapacidad de forma significativa durante el seguimiento de manera independiente sobre las recaídas y sobre el EDSS 30. Sormani et al. en el estudio multicéntrico involucrando los 9 centros de MAGNIMS también describió las lesiones en resonancia y el riesgo de progresión de la enfermedad y demostró que esta aumenta significativamente cuando aparecen ≥3 nuevas lesiones independientemente de otros factores como recaídas y modificación del EDSS 26. Aunque el punto de corte puede ser subjetivo en la práctica clínica, los datos previos sugieren que el punto de corte de la RM sería de 3 o más lesiones T2 nuevas asociadas con mal pronóstico a corto y largo plazo 17,26,31. Respecto al EDSS, la progresión sostenida de la discapacidad en pacientes con EMRR, después de iniciar y con al menos 6 meses de tratamiento utilizado de forma correcta, muestra la persistencia de la actividad de la enfermedad 29,32. Desde los trabajos iniciales de Río et al. Se demostró la utilidad clínica de la progresión del EDSS como marcador independiente de falla al tratamiento, así como la combinación de este marcador con actividad en la RM y con la presencia de recaídas para predecir e identificar la falla al tratamiento 13-15. Esta escala no está exenta de críticas, siendo las principales su naturaleza ordinal 33, la moderada correlación inter e intra-observador 34, la dependencia en su valoración de la capacidad de caminar que tiene el paciente sobre todo a partir de puntuaciones de 4.0 y su insensibilidad para detectar otros aspectos relevantes de la discapacidad, como por ejemplo la afectación de miembros superiores o los déficits cognitivos 35. En línea con lo antes mencionado en terapias de mantenimiento, la combinación persistente de actividad ha demostrado incrementar el riesgo de progresión de la enfermedad durante el seguimiento. Rio et al en el seguimiento a tres años demostró que aquellos pacientes que tenían la combinación de lesiones en la resonancia e incremento del EDSS presentaban un incremento de riesgo significativo de progresión de la enfermedad durante el seguimiento (OR 24.7, p=0.006) 16. De la misma manera, la persistencia de actividad inflamatoria focal traducida por recaídas y lesiones en la secuencia T2 o en T1 con GAD manifiesta falla al tratamiento. Rio et al muestra que la combinación de brotes y recaídas incrementa el riesgo de nuevos brotes y progresión de la enfermedad durante el seguimiento (OR 7.9 p= <0.001 y OR 9.1 p=0.003 respectivamente)16, mientras que Sormani et al, confirma estos resultados que si bien el riesgo de falla y progresión no es el mismo es significativamente mayor que en pacientes en los que no se observa actividad (probabilidad de no progresión del EDSS a los tres años 72% para pacientes con 1 recaída y ≤2 lesiones en RM)26. Los pacientes EMRR pueden presentar deterioro cognitivo (velocidad de procesamiento, atención/vigilancia sostenida y memoria verbal siendo los principales dominios afectados) 12,17,36-38. La progresión del deterioro cognitivo se relaciona con peor pronóstico en términos de afectación laboral, disfunción social, calidad de vida y desórdenes familiares 36-38. Actualmente, las evaluaciones frecuentes de la función cognitiva son recomendadas para identificar disfunciones que podrían ser manejadas 6,12. Sin embargo, no existe un acuerdo unánime sobre si los cambios cognitivos indican progresión de la enfermedad en ausencia de otra evidencia clínica y/o radiológica 12,17,31. Se necesitan más datos en este campo para determinar el rol de los cambios en la cognición al momento de definir una falla en el tratamiento en curso y decidir un cambio o no en el mismo. Algo similar ocurre desde la medición de atrofia cerebral. Los estudios de seguimiento a largo plazo han demostrado que la atrofia cerebral temprana se correlaciona significativamente con progresión de la discapacidad tanto física como cognitiva en pacientes con EM 39-45. Esta medida es muy utilizada en los ensayos clínicos de fase III 43,44. Sin embargo, la detección confiable de la atrofia en pacientes individuales en el contexto de la práctica clínica constituye un gran desafío clínico por las numerosas limitaciones que presenta 24,44. Entre estas encontramos factores tales como la pseudoatrofia inducida por el tratamiento, la disponibilidad de la medición, el fenómeno de hidratación, el tabaquismo y otros factores externos que pueden sesgar la medición y afectarla independientemente de la enfermedad 24. Es por lo anterior que, si bien la comprensión de la pérdida de volumen cerebral ha aumentado en los últimos años, aún no puede recomendarse en clínica para su uso en la toma de decisiones individualmente en los pacientes afectados para el diagnóstico, pronóstico o identificación del fracaso del tratamiento 12,24,31.
Terapias de reconstitución (alemtuzumab/cladribine)
Las terapias de reconstitución inmune representan un concepto emergente para el tratamiento de la esclerosis múltiple ya que, siendo administradas durante un corto periodo de tiempo, son capaces de inducir la remisión a largo plazo de la enfermedad 4,6,7,25. El efecto biológico de estos fármacos es mucho más prolongado que su vida media y por lo tanto definir la falla terapéutica y su manejo ulterior difiere claramente de lo establecido y consensuado en relación con las terapias de mantenimiento o escalamiento 4,6,7,25.
Como se ha dicho anteriormente y considerando que el efecto biológico de las terapias de reconstitución inmune es mucho más prolongado que su vida media, definir la falla terapéutica no solo difiere de lo establecido con relación a las terapias de mantenimiento o escalamiento, sino que por el momento no existe un claro consenso.
Meuth y col46, consideran que una significativa actividad de la enfermedad definida como la presencia de una recaída severa o ≥2 recaídas o la progresión en ≥1 puntos en la escala EDSS y confirmada a 6 meses durante el 1er año de tratamiento con terapias de reconstitución inmune, debería ser considerada una falla al tratamiento y estos pacientes cambiados a otra terapia de alta eficacia. Estos son particularmente aplicables a pacientes en los que la actividad de la enfermedad bajo tratamiento es mayor o más grave respecto de la terapia previa.
La respuesta a alemtuzumab deberá ser interpretada en el contexto de los tratamientos previos recibidos y su mecanismo de acción. Esto es especialmente válido para pacientes que recibieron tratamiento con fármacos secuestradores de leucocitos (natalizumab y fingolimod) antes de su cambio a alemtuzumab, dado que la suspensión de estos se asocia a una reactivación clínica y/o imagenológica de la enfermedad. Cierto grado de actividad de la enfermedad puede presentarse durante el 1er año de tratamiento hasta tanto alemtuzumab inicia su acción 47.
En el caso de cladribine, una actividad moderada de la enfermedad después de completar el primer ciclo de tratamiento no proporciona una razón de peso para modificar la conducta terapéutica particularmente si esta actividad ocurre precozmente (<3 meses) durante el 1er año de tratamiento, ya que podría relacionarse con un efecto inmunológico incompleto del fármaco. Para evaluar completamente la eficacia del tratamiento, estos pacientes deberían completar el segundo curso de tratamiento durante el año 2.
Los pacientes incluidos en los estudios pivotales fase II y III de alemtuzumab podían ser retratados si reunían criterios de actividad de la enfermedad (definida como ≥1 recaídas o ≥2 nuevas lesiones en T2 o agrandamiento de previas o nuevas lesiones gadolinio positivas) luego de completados los 2 años de tratamiento. Esta actividad debía ser sensiblemente menor a la presentada por el paciente antes del inicio de la terapia. En la fase de extensión a 5 años, un 30% de los pacientes recibieron un 3er curso, 12% un 4to, 2% un 5to , y un 1% un 6to. En todos los casos se administraron 12 mg de alemtuzumab en 3 días consecutivos 48.
El retratamiento con cladribine durante los años 3 y 4 no ha sido formalmente investigado en el contexto de un ensayo clínico. La extensión del estudio CLARITY (CLARITY EXT) mostró una mayor incidencia de linfopenia y otros efectos adversos en los pacientes que sostuvieron el tratamiento con cladribine durante los años 3 y 4 sin beneficios adicionales sobre la actividad de la enfermedad 25.
La persistencia de actividad clínica o imagenológica de la enfermedad más allá del año 4 representa una falla al tratamiento y los pacientes deben ser cambiados a otra terapia de alta eficacia 46.
La persistencia de actividad focal de la enfermedad reflejada en la RM a través de la aparición de nuevas lesiones en T2 o T1 con GAD o en la clínica a través de las recaídas es un claro indicador de inadecuado control de la enfermedad por parte de cladribine.
Meuth y col.46 también consideran que la presencia de >2 nuevas lesiones en la RM de cerebro o bien 1 nueva lesión en la RM medular luego de haber completado el 1er año de tratamiento con cladribine debería ser considerado como una falla terapéutica.
Debe tenerse en cuenta que la persistencia de una significativa actividad combinada de la enfermedad (recaídas, actividad en la RM y progresión de la discapacidad medida por EDSS), una vez iniciado o completado el tratamiento con terapias de reconstitución inmune, refleja la posibilidad de que el fenómeno inmunomediado no se encuentre adecuadamente controlado por lo que el cambio a una terapia de alta eficacia debe ser considerado.
En nuestro consenso proponemos simples recomendaciones tendientes a optimizar el seguimiento del paciente con EMRR en tratamiento, con el objetivo de rápidamente detectar actividad de la enfermedad y definir una falla al tratamiento, entendiendo que la definición de una falla debe llevar a tomar una conducta de cambio del tratamiento para evitar la pérdida de tiempo que conduzca al paciente a la pérdida irreversible del parénquima del SNC y la consecuente acumulación de discapacidad física y/o cognitiva.
Una limitación importante de estas recomendaciones es el acceso a los estudios necesarios para poder identificar la actividad (la resonancia principalmente) por un lado y el poder evaluar al paciente de forma apropiada para identificar cambios en su estado físico que hablen de actividad de la enfermedad. Sin embargo, la optimización del uso de las técnicas de resonancia, así como una mejora en la evaluación de los pacientes y una mayor comprensión del fenómeno patológico están permitiendo aplicar de forma más precisa y precoz estos aspectos en la identificación de la falla al tratamiento en EM 24.
En conclusión, estas recomendaciones de consenso intentan contribuir a definir la falla al tratamiento en EMRR basado en la evidencia existente, en la experiencia médica local y en la práctica clínica asistencial. Esperamos que este documento ayude a los médicos, financiadores y otros profesionales involucrados en el cuidado de pacientes con EM, a tomar decisiones en su práctica clínica diaria local. También esperamos contribuir a la mejora del estándar de atención de los pacientes con EM en nuestro País.
*RM de seguimiento: es la RM realizada posterior a la RM basal, que es la que se realiza a los 6 meses de haber comenzado la terapia seleccionada.
Dr. Luis Alberto García Valle ha participado en actividades educativas patrocinadas por los laboratorios Merck, Roche y Procter and Gambel. Dr. Gerardo Ali Reyes ha recibido Fondos para investigación de Servier y Supernums Pharmaceutical. Dra. María J. Ayerdis, Dr. José Luis Giroud, Dr. Jorge Martínez Cerrato declaran no tener conflicto de interés.
El siguiente trabajo se realizó a través un grant irrestricto del laboratorio Roche CAC. El sponsor no intervino en las afirmaciones a desarrollar ni en el contenido científico a tratar.
1: Enfermedad activa o con actividad: la enfermedad está activa o con actividad desde la clínica cuando hay recaídas o brotes de la enfermedad/ desde la resonancia cuando aparecen una o más nuevas lesiones en el T1 con realce de contraste o en las secuencias T2.
2: Enfermedad progresiva o progresión de enfermedad: se habla de enfermedad progresiva o progresión de enfermedad cuando se objetiva un incremento en la discapacidad física sin recuperación o retorno al estado funcional previo. La progresión es clínica, no habiendo parámetros de resonancia para definir este proceso.
3: Empeoramiento de la enfermedad: incremento de la discapacidad física como resultado de recaídas clínicas o de la progresión de la enfermedad.
4: Progresión o empeoramiento confirmado: incremento de la discapacidad física confirmada luego de un período determinado de tiempo (por ejemplo 3, 6 o 12 meses). La confirmación habla de irreversibilidad
5: Incremento de la discapacidad física: en EM se han propuesto múltiples escalas, la más comúnmente utilizada en la práctica clínica y en el contexto de los ensayos clínicos es el incremento de la discapacidad medido por el EDSS.