

Venus María Tapia López
Médico Patóloga-Oncóloga. Departamento de Patología Hospital Escuela Bertha Calderón Roque, Managua, Nicaragua.
venustapialopez@gmail.com, https://orcid.org/0000-0001-7972-7357
El cáncer de mama constituye el cáncer invasivo más frecuente en mujeres, afectando a una de cada 8 mujeres a lo largo de su vida, además, representa la primera causa de muerte por cáncer en la mujer a nivel mundial. Las mujeres jóvenes representan únicamente el 3% del total de casos diagnosticados; sin embargo, estas pacientes presentan tumores de mayor tamaño e índice de proliferación mayor en comparación con las mujeres de mayor edad, de igual forma en el cáncer de mama de inicio temprano se sobre expresan subtipos histológicos y moleculares más agresivos y de peor pronóstico.
En general, el cáncer de mama en mujeres jóvenes está relacionada con una biología tumoral mayormente agresiva y peor evolución clínica. Los tumores de tipo basal y HER2 positivos son más frecuentes diagnosticados en mujeres jóvenes con cáncer de mama en un 34,3% y 22% respectivamente, se describe con mayor frecuencia la metástasis ganglionar, enfermedad multifocal y alto grado tumoral, en comparación con la población de mayor edad. Generalmente son diagnosticados en etapa avanzada. Todas estas características actúan como factores de mal pronóstico aumentando la tasa de mortalidad hasta 1,5 veces y mayor tasa de recidiva en comparación con los pacientes mayores.
En los estudios que analizan la expresión génica de los tumores, en el grupo de pacientes jóvenes, se ha identificado hasta 63 genes que específicamente aparecen alterados, a través de los cuales se pueden estudiar las vías moleculares que se ven afectas, siendo alteraciones oncogénicas específicas y distintas de las que promueven la tumorogénesis en pacientes con mayor edad.
Palabras clave: Cáncer de inicio temprano, Mutaciones genéticas, Vías moleculares
Breast cancer is the most common invasive cancer in women, affecting one in 8 women throughout their lives, furthermore, it represents the leading cause of cancer death in women worldwide. Young women represent only 3% of all diagnosed cases; however, these patients have larger tumors and a higher proliferation index compared to older women. Similarly, in early-onset breast cancer, more aggressive histological and molecular subtypes with a worse prognosis are overexpressed.
In general, breast cancer in young women is related to a more aggressive tumor biology and worse clinical evolution. Basal-type and HER2-positive tumors are more frequently diagnosed in young women with breast cancer in 34.3% and 22% respectively, lymph node metastasis, multifocal disease and high tumor grade are described more frequently, compared to older population. They are generally diagnosed in an advanced stage. All of these characteristics act as poor prognostic factors, increasing the mortality rate up to 1.5 times and a higher recurrence rate compared to older patients.
In studies that analyze the gene expression of tumors in the group of young patients, identifying up to 63 genes that specifically appear altered, through which the molecular pathways that are affected can be studied, being specific oncogenic alterations and different from those that promote tumorigenesis in older patients.
Key words: Early onset cancer, Genetic mutations, Molecular pathways
Cada año se diagnostican 1.67 millones de mujeres con cáncer de mama y 522,000 fallecen por esta enfermedad a nivel mundial. En países en vías de desarrollo la supervivencia a 5 años es de 30% a 45%, en comparación con el 80% de supervivencias en países desarrollados, lo que se debe a al momento de detección de la enfermedad. En los países en desarrollo, más del 53% de los casos se detecta en estadios avanzados y el intervalo de tiempo es vital para el pronóstico, se ha encontrado intervalo de hasta 3 meses desde el primer contacto de la paciente con la atención médica, hasta el diagnóstico definitivo y manejo correcto de su enfermedad1.
El cáncer de mama es una enfermedad caracterizada por tener diversos comportamientos clínicos y diferentes características biológicas, haciendo que el proceso de diagnóstico, predicción, pronóstico y el manejo, sea más desafiante para los médicos, cirujanos, patólogos y oncólogos, debido a que presenta diferentes perfiles moleculares.
Generalmente el cáncer afecta a mujeres mayores de 40 años. Sin embargo, en mujeres jóvenes (<40 años) representa el 6%–10% de todos los casos de cáncer de mama en los países desarrollados y el 20% en los países en desarrollo. Las tasas de mortalidad representan el 7% vs. 14% para países desarrollados y en vías de desarrollo, respectivamente.
La edad se considera per se, un factor de riesgo asociado a cáncer de mama, además de representar un factor pronóstico, siendo de peor pronóstico en mujeres jóvenes. El perfil molecular por inmunohistoquímica, más frecuentemente presentado, en mujeres menores de 40 años es el subtipo triple negativo (Receptor hormonales de estrógeno y progesterona negativo y HER2 NEU negativo), en cambio, en pacientes postmenopáusicas (60 -69%) la incidencia más frecuentemente reportada son los subtipos Luminal A (Receptor hormonales de estrógeno y progesterona positivo y HER2 NEU negativo), que representan mejor pronóstico para estas pacientes. Además, en mujeres jóvenes se describen más frecuentemente subtipos histológicos de alto grado y con mayor índice de proliferación2.
La mamografía, ha demostrado ser herramienta muy efectiva para el cribado de cáncer de mama en mujeres mayores, pero no es una herramienta adecuada para la detección de cáncer en las mujeres jóvenes, debido a que éstas tienen tejido mamario denso y limita la detección de tumores o calcificaciones. Debido a la falta de herramientas de detección adecuadas, las mujeres más jóvenes son a menudo diagnosticadas en una etapa tardía de la enfermedad en comparación con las mujeres de mayor edad.
En la literatura científica existe mucho menos información respecto a la prevalencia de inmunofenotipos de cáncer de mama en pacientes jóvenes que respecto a los inmunofenotipos de cáncer de mama en todos los grupos de edad. Tradicionalmente, este tipo de neoplasia a edades tempranas se ha asociado con altas tasas de recidiva y con una menor supervivencia, por lo que sería esperable encontrar tumores con fenotipos agresivos.
Los tópicos abordados incluyen: Etiología; perfiles moleculares, diagnóstico histopatológico, genes involucrados y patología molecular del cáncer de mama de inicio temprano.
Glándula mamaria, estructura histológica:
La mama tiene dos tipos de células epiteliales, dos tipos de estroma y dos estructuras principales.
Tipos de células epiteliales: Los dos tipos de células epiteliales presentes en el tejido mamaria son las células luminales y las células mioepiteliales (tabla 1). Además, pueden estar presentes células precursores progenitores o células madres, estas últimas para su reconocimiento se requieren de aplicación de técnicas especiales, pueden ser denominadas como células intermedias o basales, estas pueden dar a lugar a células luminales y mioepiteliales, apoyando con esto la teoría de aparición de neoplasias clonales compuesto de ambos tipos de células (por ejemplo: mioepiteliomas, carcinoma adenoide quístico). Generalmente son inmunorreactivas para citoqueratinas de alto peso molecular (citoqueratinas 5/6), visto en hiperplasia epitelial, lo que comprueba la presencia de una población mixta de múltiples tipos de células3.
Células luminales: Forman la capa más interna que recubre conductos y ácinos. Las células luminales en unidad ducto lobulillar terminal, producen leche. Las células luminales en los conductos más grandes no experimentan lactancia. Las células tienen forma cuboidal a columnar, los núcleos son pequeños, de redondos a ovalados, por lo general tienen nucléolos discretos. Las células tienen una cantidad moderada de citoplasma eosinófilo. Estas células expresan queratinas de bajo peso molecular luminal 7,8, 18, 19. También puede expresar queratinas basales3. Las células luminales son células precursoras de la mayoría de los carcinomas de mama4.
Características clinicopatológicas del cáncer de mama en mujeres jóvenes:
La European Society of Breast Cancer Specialists (EUSOMA) define cáncer de mama en mujeres jóvenes, como aquel grupo de mujeres con cáncer de mama con una edad menor de los 40 años. Las mujeres menores de 40 años presentan características propias como el deseo de la fertilidad, el embarazo y la lactancia materna, a diferencia en las mujeres mayores de 40 años, lo que implica un enfoque distinto y establecer diferencias entre mujeres mayores, peri- y pre-menopáusicas5.
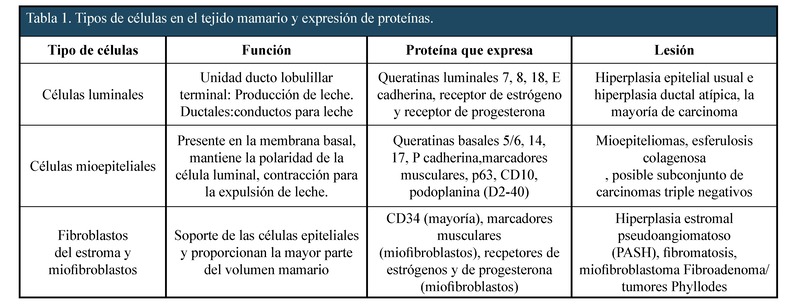
El cáncer de mama en mujeres muy jóvenes se caracteriza por ser típicamente más agresivos, los tumores son macroscópicamente de mayor tamaño, (fig.1) más indiferenciados, con mayor afectación ganglionar, sobreexpresión de HER2 y ausencia de receptores hormonales, todo esto le confiere mal pronóstico. La tasa de supervivencia a 5 años es de 83% para las mujeres más jóvenes, más baja que la tasa de supervivencia para las mujeres post-menopáusicas. La Conferencia de St. Gallen de 1998, estableció que, edades por debajo de 35 años actúan como variable con valor pronóstico5.
El cáncer de mama en mujeres jóvenes, presenta una mayor proporción de antecedentes de cáncer de mama en familiares en comparación con cáncer de mama que pacientes mayores (24% vs. 17%).
El cáncer de mama es una enfermedad heterogénea. Su pronóstico está asociado a diferentes factores morfológicos clásicos como el tamaño tumoral, el grado histológico, el estado de los ganglios axilares, la invasión vascular, la presencia de necrosis y la distancia a los márgenes de resección. Algunos de estos factores están incluidos en el sistema de estadificación TNM, el cual permite agrupar a las pacientes, según el nivel de progresión tumoral que se relaciona con la probabilidad de recidiva y, por tanto, con el pronóstico. Además, contribuye a la toma de decisiones en cuanto al tratamiento más adecuado. Desde un punto de vista histológico, las neoplasias infiltrantes de mama se han venido clasificando atendiendo a criterios bien establecidos por la Organización Mundial de la Salud (OMS) en diferentes grupos: de origen epitelial, mesenquimal, mixto, linfoide o metastásico6.
Existe un amplio espectro de fenotipos morfológicos y subtipos específicos, cada uno de ellos con sus particularidades de presentación clínica y pronóstica. El carcinoma ductal infiltrante no específico (CDI, NOS) es el tipo histológico más frecuente, supone el 75% de todos los tipos tumorales.
Estudios moleculares en mujeres jóvenes con cáncer de mama:
A lo largo de décadas los mecanismos implicados en el cáncer de mama han sido exhaustivamente investigados, sin embargo, todavía existen retos a la hora de establecer un diagnóstico precoz y específico de cada paciente, para determinar y predecir su respuesta y resistencias adquiridas al tratamiento.
Lin y colaboradores, 2011, determinan que en mujeres menores de 35 años, las mutaciones en TP53, el porcentaje de Ki67 y la expresión de HER2 tienen mayor valor pronóstico en comparación con la expresión de marcadores hormonales, los cuales generalmente son negativos en este grupo de edad. Los biomarcadores empleados para cáncer de mama en general, podrían no ser del todo adecuados para mujeres muy jóvenes con cáncer de mama 7.
Anderson y Matsuno, 2006, basándose en la distribución de la edad de diagnóstico y en su tasa de mortalidad, definieron el cáncer de mama como una mezcla de, al menos, dos tipos de cáncer. El primero tendría su edad de aparición alrededor de los 50 años y el segundo se daría en mujeres de más de 65 años, pudiendo ser definidos como pre y post-menopáusicos 8.
Existe una expresión de genes diferente en tejido tumoral mamario según la edad, separando los perfiles en mujeres muy jóvenes (menores de 35 años), mujeres jóvenes (de 35 a 45 años), pre-menopáusicas (de 45 a 55 años) y mujeres mayores (de 55 años en adelante). Analizando por separado los perfiles distintivos de cada grupo, destacan que los procesos biológicos enriquecidos asociados con genes desregulados en mujeres muy jóvenes (menores de 35 años) incluían control del ciclo celular, morfogénesis, proliferación y muerte celular, entre otros. De manera similar al perfil obtenido para mujeres jóvenes (de 35 a 45 años), los análisis de redes biológicas indicaron alteraciones en las rutas de señalización de MAPK, PI3K/Akt y NFkB, además de revelar como potencialmente importantes los genes IL1RN, ESR1 y la familia de ERBB29.
Mutaciones de línea germinal:
Las mutaciones de línea germinal adquiridas en la reparación del ADN y los genes supresores de tumores son la forma más común de susceptibilidad genética al cáncer de mama, que conduce a la acumulación de mutaciones en el punto de control del ciclo celular y oncogenes que se requieren para división celular aberrante. Alrededor del 10% al 20% de los casos de cáncer de mama temprano son hereditario, BRCA 1 y BRCA2 son los genes mutados más comunes relacionados con el cáncer de mama desde su descubrimiento a principios de la década de 199010.
Las mutaciones relacionadas con el desarrollo de cánceres a menudo se clasifican como mutación de penetrancia alta, intermedia y baja en función de su riesgo relativo para el cáncer específico. BRCA1, BRCA2, TP53, PTEN, STK11 y CDH1 se consideran mutaciones de alta penetrancia y representan el 20% del riesgo hereditario. Seguido por mutaciones de penetrancia moderada, que incluyen PALB2, BRIP1, ATM, CHEK2, y RAD51C, que representan alrededor del 5% del riesgo hereditario. Además, más de 180 mutaciones que se consideran de bajo riesgo para el cáncer de mama, lo que explica solo el 18% del riesgo familiar. Todas estas proporciones de riesgo relativo definen solo la mitad del riesgo genético de cáncer de mama, con la otra mitad aún desconocida10.
BRCA1, un gen supresor de tumores, codifica una proteína de 220 KDa en la respuesta a roturas de doble cadena (DSB) por recombinación homóloga (HR). La Mutación BRCA1 causa defecto en la reparación mediada por recombinación homóloga y pérdida de función para inhibir la tumorogénesis tumoral. Aunque la mutación BRCA1 es rara en el cáncer de mama esporádico, pero la reducción de la expresión nuclear de BRCA1 en tejido de cáncer de mama es común11.
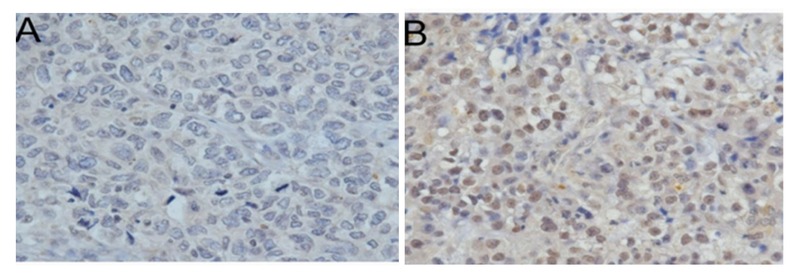
Xiang et al.12 encontraron que el 69% de los casos fueron negativos para BRCA1 IHC tinción en 101 pacientes con cáncer de mama, y también tenían mayor expresión de Ki-67. La expresión reducida de BRCA1 también se asoció con estadio avanzado de la enfermedad y metástasis a ganglios linfáticos, histología de alto grado, tumor de mayor tamaño, invasión vascular, receptor de estrógeno y/o progesterona negativos, expresión del receptor de andrógenos y expresión positiva de p53. Bogdani et al 13, encontraron que la ausencia de tinción nuclear de BRCA1 era más más frecuente en mujeres jóvenes que en pacientes mayores. La expresión ausente o débil de BRCA1 nuclear parece ser un predictor de pobre pronóstico11, (fig. 2).
Mutaciones somáticas
En diferentes estudios, mediante secuenciación de nueva generación (NGS), las mutaciones patógenas más frecuentemente encontradas en pacientes jóvenes con Cáncer mama fueron de PIK3CA y TP53, seguidos de mutación de BRCA2 y PTEN en el 5% de frecuencia. Otras mutaciones detectadas en menor porcentaje en estas pacientes por NGS incluyen: ATM 2%, AKT 4%, CHEK2 4%, NRAS 2%, CDKN2A 2%, NF1 2%, RB1 2%, FGFR1 2% y ERBB2 2% 14.
TP53
En cáncer de mama de mujeres jóvenes, existe alta carga mutacional de TP53 lo que afecta la tasa de la transcripción de GAS7b; teniendo en cuenta el papel de GAS7b en la regulación de la estructura celular y su migración, esta transcripción aberrante puede contribuir a los eventos de metástasis. Lo que aún se debe de investigar más profundamente 10.
Las variantes de la línea germinal TP53 son la causa genética de Li-Fraumeni (LFS), un síndrome de predisposición al cáncer hereditario asociado con el cáncer de mama femenino de inicio muy temprano, comúnmente antes de los 31 años. La mutación patógena c.824G>A localizado en la codificación del exón 7 del gen TP53 ha sido identificado como un gen mutado en la línea germinal patógena TP53. Las mujeres jóvenes portadoras de estas variantes, tienen un riesgo alto de presentar cáncer de mama después de la segunda década, el que se eleva hasta un 20%-30% por debajo de los 31 años, alcanza un pico entre 25 y 35 años y cae después de 40 años de edad. Las mujeres jóvenes que portan mutaciones de la línea germinal en el gen TP53 tienen un riesgo acumulado de 5-8% de presentar cáncer de mama antes de los 30 años. Se ha demostrado que las mutaciones de la línea germinal de TP53 se asocian con tumores caracterizados por alto grado, sobreexpresión de HER2 en el 60-83% de los casos y multifocalidad, lo que caracteriza histopatológicamente el cáncer de mama en mujeres jóvenes. En general, las pruebas de línea germinal TP53 deben aplicarse sistemáticamente a todos los pacientes diagnosticados de cáncer de mama invasivo o carcinoma ductal in situ (DCIS) antes de los 31 años de edad 11.
Vía de señalización de PI3K/Akt/mTOR.
Esta ruta intracelular ha suscitado mucho interés en los últimos años como potencial diana terapéutica y determinar su papel en los diferentes subtipos de cáncer de mama entre las pacientes más jóvenes. Diferentes estudios en pacientes con cáncer de mama de inicio temprano, se ha demostrado que existe alteración de la expresión Inmunohistoquímica de alguno de los componentes de la vía IGF1R, PTEN/Akt/mTOR entre las pacientes jóvenes. La sobreexpresión de IGF1R en el subtipo Luminal B-like/HER2+ y la pérdida de expresión de PTEN en el subtipo TN/Basal apoya que la alteración de esta vía está relacionada con la patogenia de estos subtipos moleculares, y a su vez, debería considerarse su potencial relevancia como diana terapéutica en un futuro próximo 6.
Esta vía molecular intracelular tiene un papel clave en la regulación de la supervivencia celular, proliferación, migración, apoptosis, metabolismo y angiogénesis.
Las fosfatidilinositol-3-quinasas (PI3K), son una familia de enzimas, cuyas funciones son fosforilar el grupo hidroxilo de la posición 3' del anillo de inositol en la membrana plasmática y generar segundos mensajeros importantes. Conocemos actualmente tres diferentes clases de PI3K, que a su vez se dividen en subclases según su afinidad por algunos sustratos, su homología y las funciones que cumplen. La clase I es la mejor caracterizada en cuanto a su implicancia en la patogénesis del cáncer y sus PI3K se dividen en subclase IA y IB.
PI3K clase IA consiste de una de tres isoformas catalíticas (p110 a, b, y d) codificadas por los genes PIK3CA, PIK3CB, y PIK3CD, y una subunidad reguladora, que puede ser p85α o sus variantes por splicing (p55α y p50α), p85β o p55g. Además, la subunidad catalítica p110α, puede estar regulada por los receptores TK, de unión a factores de crecimiento y, también, por los receptores asociados a proteínas G. Las mutaciones activantes de PI3KCA en diversos ‘‘hot spots” se producen con más frecuencia en las posiciones E542K, E545K y H1047R. Éstas constituyen más del 80% del total de mutaciones descritas en PI3KCA en cáncer de mama. Los resultados de estudios in vitro y con cristalografía por rayos X sugieren que las mutaciones en E542K y E545K (exón 9) anulan las interacciones moleculares, mientras que las mutaciones en el exón 20 (dominio H1047R) producen una activación constitutiva del gen. En estudios con ratones transgénicos, la inactivación genética o farmacológica de la expresión de PIK3CA (H1047R) da como resultado la desaparición de tumores mamarios. Sin embargo, algunos de ellos recidivan y pueden hacerse resistentes a la inhibición de PI3K por la vía de c-myc. En otros estudios se ha podido demostrar que las mutaciones en el exón 20 de PIK3CA son relativamente frecuentes, pudiendo ocurrir hasta en el 23-33% de tumores de subtipo HER2 6.
Además de su actividad para favorecer el crecimiento y supervivencia celular, la vía PI3K interactúa con los receptores de estrógenos (RE) de forma directa e indirecta ya que ésta puede ser activada por los RE. Además, la activación de la vía PI3K puede dar lugar a resistencia antiestrogénica, como ha sido demostrado en diversos modelos experimentales, la cual puede revertirse tras la inhibición de la vía PI3K. Por ello, determinados estudios sugieren que la combinación de antiestrógenos y de inhibidores de la vía PI3K puede ser una estrategia clínicamente más efectiva que el empleo de tratamiento antiestrogénico único 6.
Se ha demostrado que las mutaciones activantes de PIK3CA provocan resistencia a tratamientos anti-HER2 como Trastuzumab®, debido a la activación adicional en esta ruta, independientemente de los dímeros HER2/HER3. También se ha descrito que los tumores HER2 positivos son sensibles a los inhibidores de PI3K y de mTOR, tanto antes como después de adquirir resistencia a tratamientos con Trastuzumab® y/o Lapatinib® (inhibidor dual de HER1/HER2) 6.
La activación de mTOR en cáncer de mama se ha descrito asociada a tumores de fenotipo agresivo. Hasta la fecha, existen algunos estudios que han analizado el estado de mTOR y el efecto de estos tratamientos en mujeres postmenopáusicas con cáncer de mama. Sin embargo, existen pocos trabajos en la literatura que analicen el estado de mTOR en el subgrupo de mujeres jóvenes. Recientemente, se ha sugerido que mTOR es un efector potente en el tratamiento con Lapatinib. También se ha establecido la relación existente entre la resistencia al tratamiento antiestrogénico en tumores de mama RE positivos y la activación de mTOR. La inhibición de mTORC1 provoca un feedback negativo en todos los receptores que pueden activar la vía PI3K (IGF1R, IRS-1 y HER3) lo que sugiere que la inhibición directa de la vía puede ser muy efectiva 15.
miRNAs en cáncer de mama
El papel de los miRNAs en la aparición de cáncer de mama en mujeres jóvenes, poco se conoce. Dos trabajos similares relacionan la presencia de un polimorfismo funcional en el gen del miR-146a con un adelanto en la edad de aparición de cáncer de mama. Al igual se relaciona un polimorfismo en la zona de unión del miR-502, localizada en la región 3’UTR del gen SET8, con un adelanto en la edad de aparición de cáncer de mama 16.
Un estudio en mujeres libanesas con cáncer de mama reveló una sobreexpresión del miR-155 en pacientes menores de 40 años, al compararlo con mayores de 40 años 17. Existe también asociación descrita entre el perfil de miRNAs y el cáncer de mama familiar no debido a BRCA1/2, un tipo de cáncer que se origina principalmente en mujeres jóvenes 18.
Los miRNAs han mostrado un potencial valor pronóstico, así como de dianas terapéuticas. Es por eso que, desde que en 2005 se informó por primera vez una desregulación de miRNAs en cáncer de mama, son muchos los estudios que han dirigido sus esfuerzos a investigar la expresión de miRNAs en cáncer de mama y su papel en el desarrollo de la enfermedad. Gasparini y colaboradores 19, aseguran que la detección combinada de los miRNAs miR-155, miR-493, miR-30e y miR-27a, junto con las técnicas rudimentarias de detección inmunohistoquímica, separa las pacientes de cáncer de mama triple negativo en un grupo de alto riesgo y otro de bajo riesgo 20.
El proceso de transición epitelio-mesénquima es esencial durante el desarrollo embrionario de los mamíferos; sin embargo, este proceso se ha relacionado con el inicio de procesos cancerosos y su progresión. Está caracterizado por la pérdida del marcador epitelial E-cadherina, de proteínas de adhesión celular y de la polaridad de la célula. Además, la transición de epitelio a mesénquima es importante también en el cáncer de mama para establecer el inicio de la carcinogénesis, ya que las células cancerosas reproducen el comportamiento de las células madre normales. Yu y colaboradores fueron los primeros en estudiar la expresión de miRNAs en células madre de cáncer de mama (BCSCs del inglés breast cancer stem cells), para ello compararon la expresión de miRNAs en BCSCs autorrenovables y células diferenciadas provenientes tanto de líneas celulares como de tumores primarios de mama19.
De los genes diana seleccionados, se validó GRIN2B, cuya expresión de mRNA se encuentra sobre-expresada en mujeres jóvenes, concordando con la expresión de los miRNAs. La presencia de la proteína HER4 en tejido tumoral fue significativamente mayor en mujeres jóvenes. Además, la tinción en éstas fue principalmente de membrana, en contraposición a la tinción nuclear encontrada en mujeres mayores 5.
Microambiente tumoral
El microambiente tumoral juega un papel importante en la tumorogénesis del cáncer de mama y progresión. Dirigirse a los componentes malignos y no malignos del microambiente tumoral puede ayudar en el tratamiento del cáncer. Los cambios endocrinos durante la edad reproductiva y la gestación juegan un papel fundamental en la alteración de la mama. Ocho genes del estroma se expresaron diferencialmente en tumores de mama de pacientes muy jóvenes (35 años o menos) en comparación con tumores de pacientes de mayor edad (50–65 años) (UQCRQ, ALDH1A3, EGLN1 e IGF1 sobreexpresados, mientras que FUT9, IDI2, PDHX y CCL18 sobre-expresados.
El cáncer de mama de inicio temprano tiene una etiología diversa, que involucra diferentes vías de tumorogénesis y mutaciones genéticas. Se relaciona principalmente con aquellas vías que otorgan pronósticos adversos, en presentación clínica e histológica y clasificación molecular de tumores de alto grado y con proliferación alta.
Aún se encuentran estudios en investigación para descubrir nuevos marcadores moleculares asociados exclusivamente con cáncer de inicio temprano, que pueden ayudar a personalizar la terapia para este grupo de pacientes. Además, de investigar genes específicos relacionados con el microambiente tumoral y proteínas de la matriz extracelular.
Diferentes vías, en especial las mutaciones de TP53 pueden ser un área prometedora para futuras investigaciones, de cáncer de mama en mujeres jóvenes.
A las doctoras y doctores del Hospital Escuela Bertha Calderón Roque: Alejandra Yahoska Jirón Ayerdis, Servicio de neonatología; Alison María García Rivera, Departamento de Radiología; Maryina Feliza Malespín Matamoros, Servicio de emergencia; Karla Valle Carcache, Servicio de emergencia; María Amparo Morales Acuña, Servicio de Medicina Materno Fetal; Rita Isabel López Solano, Servicio de alto riesgo obstétrico; Juan José Almendarez Martínez, Servicio de uroginecología; Goizeder López Rubio, Servicio de cirugía general.