ISSN 2410-5708 / e-ISSN 2313-7215
Vol 13 | No. 38 | Octubre 2024 - Enero 2025
© Copyright (2024). Universidad Nacional Autónoma de Nicaragua, Managua.
Este documento está bajo una licencia Creative Commons
internacional Reconocimiento-NoComercial-SinDerivados 4.0.
Migración de Bromuro de Etidio a GelRed en la tinción de Ácidos Nucleicos en Gel de Agarosa.
https://doi.org/ 10.5377/rtu.v13i38.19325
Enviado el 26 de Septiembre, 2024 / Aceptado el 10 de Octubre, 2024
Oscar Arbizú Medina
Docente titular UNAN-Managua/ Responsable de Laboratorio de
Biología Molecular “MA. Elmer Cisneros in memoriam”, Instituto
Politécnico de la Salud, Universidad Nacional Autónoma de
Nicaragua, Managua, UNAN-Managua
Francisco Romero Oviedo
Docente investigador Laboratorio de Biología Molecular “MA.
Elmer Cisneros in memoriam”, Instituto Politécnico de la Salud,
Universidad Nacional Autónoma de Nicaragua, Managua, UNAN-Managua
Yosimar Narváez González
Investigador Laboratorio de Biología Molecular “MA. Elmer
Cisneros in memoriam”, Instituto Politécnico de la Salud,
Universidad Nacional Autónoma de Nicaragua, Managua, UNAN-Managua
Roshell Rizo Obregón
Investigador Laboratorio de Biología Molecular “MA. Elmer
Cisneros in memoriam”, Instituto Politécnico de la Salud,
Universidad Nacional Autónoma de Nicaragua, Managua, UNAN-Managua
Sección: Ciencias
ARTÍCULOS CIENTÍFICOS
Palabras Clave: ADN bacteriano, electroforesis, mutagénicos, biología molecular.
Resumen
El bromuro de etidio (EtBr) es un colorante fluorescente ampliamente utilizado para la tinción de ácidos nucleicos en geles de agarosa y poliacrilamida. No obstante, el EtBr presenta varios incovenientes, como su alta toxicidad y capacidad mutagénica, lo que restringe su uso y manejo. En este estudio, se evaluó el uso de GelRed®, un colorante alternativo desarrollado por Biotium, que ofrece una mayor sensibilidad, seguridad y estabilidad que el EtBr. Se comparó el rendimiento de ambos colorantes para la tinción de ADN amplificado por PCR, utilizando los protocolos de BCR-ABL, JACK2, BLEE, Carbapenemasas IMP, VIM, SPM, GIM, NDM, KPC, OXA, mcr-1/mcr-2 y mecA.
Los resultados indicaron que el GelRed® puede ser utilizado para visualizar el ADN con una intensidad de fluorescencia igual o mayor que la del EtBr, sin necesidad de modificar los protocolos de extracción, amplificación y electroforesis. Además, GelRed® no interfirió con las enzimas de restricción y la PCR, y no presenta efectos mutagénicos o citotóxicos. Se llega a la conclusión de que el GelRed® es una opción segura y sensible en comparación con el EtBr para la tinción de ácidos nucleicos en geles de agarosa.
Abstract
Ethidium bromide (EtBr) is a fluorescent dye widely used for staining nucleic acids in agarose and polyacrylamide gels. However, EtBr has several drawbacks, such as its high toxicity and mutagenic capacity, which restricts its use and management. In this study, the use of GelRed®, an alternative dye developed by Biotium, which offers greater sensitivity, safety and stability than EtBr, was evaluated. The performance of both dyes was compared for the staining of DNA amplified by PCR, using the protocols of BCR-ABL, JACK2, ESBL, carbapenemases IMP, VIM, SPM, GIM, NDM, KPC, OXA, mcr-1/mcr-2 and mecca.
The results indicated that GelRed® can be used to visualize DNA with a fluorescence intensity equal to or greater than that of EtBr, without the need to modify the extraction, amplification and electrophoresis protocols. Furthermore, GelRed® did not interfere with restriction enzymes and PCR, and does not exhibit mutagenic or cytotoxic effects. It is concluded that GelRed® is a safe and sensitive option compared to EtBr for staining nucleic acids in agarose gels.
Introducción
La tinción de ácidos nucleicos en geles de agarosa y poliacrilamida, es una técnica básica y esencial en los laboratorios de biología molecular, para visualizar fragmentos de ADN o ARN que son separado mediante electroforesis y visualizado mediante luz ultravioleta.
El colorante más utilizado para la tinción de ácidos nucleicos en geles es el bromuro de etidio (EtBr), un compuesto intercalante que se inserta entre las bases nitrogenadas del ADN o el ARN, y que emite fluorescencia de color naranja-rojo cuando se expone a la luz ultravioleta (UV). El EtBr es económico, sencillo de utilizar y compatible con la mayoría de los sistemas de imagenología, lo cual le otorga una ventaja (Hall, 2019).
Sin embargo, EtBr también presenta varios inconvenientes, que limitan su uso y manipulación. EtBr es un agente mutagénico y citotóxico que puede ocasionar daño al ADN y a las células vivas, lo cual representa un riesgo de cáncer tanto para los usuarios como para el medio ambiente (U de et al., 2022). Por consecuencia, EtBr debe ser manejado, almacenado y eliminado con medidas de protección y precaución. Debido a estos inconvenientes, se han desarrollado varios colorantes alternativos al EtBr, que ofrecen una mayor sensibilidad, seguridad y estabilidad. Dentro de los diferentes colorantes, se destaca GelRed®, un colorante intercalante creado por Biotium, el cual se enlaza de manera covalente al ADN o ARN y produce fluorescencia al ser expuesto a la luz UV (Masciotti, 2018).
GelRed® es impermeable a las células vivas y no contiene sustancias mutagénicas o tóxicas, lo que reduce el riesgo de exposición para los usuarios y el medio ambiente. (Debroy et al., 2022) De igual manera, tiene una mayor afinidad por el ADN y el ARN que EtBr, lo que se traduce en una mayor sensibilidad y una menor concentración necesaria para la tinción. (Hall, 2019) No afecta las enzimas de restricción ni la PCR, por lo que se puede utilizar en muestras antes o después de la electroforesis, sin tener impacto en las reacciones posteriores (Haines et al., 2015).
En este estudio, se evaluó la reproducibilidad del uso de GelRed® para la tinción de ADN en geles de agarosa en los diferentes protocolos; BCR-ABL, JACK2, BLEE, Carbapenemasas IMP, VIM, SPM, GIM, NDM, KPC, OXA, mcr-1/mcr-2 y mecA, que son aplicados en el laboratorio de biología molecular Elmer Cisneros in memorian. Se realizó una comparación entre el rendimiento de GelRed® y el de EtBr, considerando su sensibilidad, reproducibilidad y eficiencia. Se utilizaron las técnicas de tinción pre-carga y tinción de las muestras cargadas, que son los métodos más comunes para la tinción de ácidos nucleicos en geles. Se analizaron los datos y resultados obtenidos, y se discutieron las ventajas y desventajas de cada colorante.
Materiales y métodos
Extracción de ADN
La extracción de ADN sanguíneo se realizó siguiendo el protocolo del fabricante para la extracción de ADN utilizando el kit QIAamp DNA Mini Kit (Qiagen). Para extracción de ADN bacteriano, se utilizaron cultivos en agar TSA, de los cuales se obtuvo un pool de UFC para posteriormente realizar el método de extracción por calor. Se realizó la cuantificación del ADN extraído mediante el uso de un Nanodrop Lite 2763 y se verificó su calidad e integridad (Vílchez & Alonso, 2009).
Amplificación de los ADN mediante PCR
Se amplificaron fragmentos de ADN asociados a los genes BCR-ABL, JACK2, BLEE, Carbapenemasas IMP, VIM, SPM, GIM, NDM, KPC, OXA, mcr-1/mcr-2 y mecA, utilizando los cebadores y las condiciones de reacción especificados por Arbizú y col 2023, y las indicaciones del fabricante kit de PCR GoTaq Green Máster Mix (Promega). Se realizó la amplificación en un termociclador Thermal Cycler (Fisherbrand), y se verificó el tamaño y la especificidad de los productos de PCR por electroforesis en gel de agarosa al 1.5% (Arbizú Medina et al., 2023).
Gel de agarosa y tinción de ácidos nucleicos
En la preparación del gel se empleó agarosa, con una concentración de 1.5% en tampón TBE (Tris-Borato-EDTA), para ser utilizados como base en la electroforesis de ácidos nucleicos. Se utilizaron dos métodos diferentes que se adaptaron a la técnica de tinción. Para realizar la tinción post-electroforesis con GelRed, se prepararon geles sin añadir ningún tipo de colorante, para posteriormente mezclar el colorante junto al Loading Buffer en una concentración de 1:9. Se utilizó esta mezcla para cargar las muestras en el gel de agarosa, utilizando 2ul de Buffer+GelRed y 6ul de los productos de PCR amplificados. Sin embargo, para teñir un gel pre-electroforesis, se incorporó el Bromuro de Etidio, a la agarosa mediante una tinción previa. Esto se llevó a cabo agregando 0.5 µg/mL de EtBR en 100 ml de agarosa después de su fundición. En ambos métodos se proceedio a realizar la técnica de electroforesis con una condición de 120 voltio a 45-60 minutos dependiento del protocolo empleado, al finalizar la electroforesis se vizualizaron las bandas por medio de un transiluminador de luz ultravioleta y fueron fotografiados con un fotodocumentador.
Resultados
Se evaluó la eficiencia de ambos colorantes para la tinción de ADN en geles de agarosa, utilizando protocolos para encontrar mutaciones hematológicas como BCR-ABL, JACK2, BLEE, Carbapenemasas IMP, VIM, SPM, GIM, NDM, KPC, OXA, mcr-1/mcr-2 y mecA, Se amplificó el ADN se cargaron 6 µl de cada muestra en los pozos de un gel de agarosa al 1.5%. Se tiñó el gel con GelRed o EtBr, siguiendo métodos de precarga y tinción de las muestras cargadas en el buffer. Se visualizó el gel en un transiluminador UV y se capturó la imagen con un fotodocumentador.
La Figura 1, se Añadir muestran las imágenes de los geles teñidos con EtBr para el protocolo del laboratorio y observa que ambos colorantes permitieron visualizar los productos de PCR y sus pb, con una intensidad de fluorescencia similar.
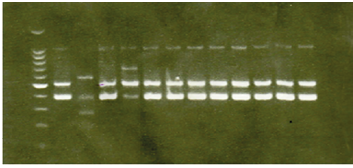
Figura 2, Estos resultados indican que el gelred tiene una reproducibilidad similar o ligeramente superior a la del EtBr para la tinción de ADN en geles de agarosa, tinción de las muestras cargadas en el buffer. El marcador de peso molecular (M) es de 100 pb.
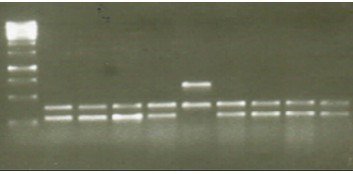
Figura 3. Comparación de la reproducibilidad de gelred para la tinción de ADN en geles de agarosa, ADN amplificado por los protocolos de laboratorios teñido con Gelred por el método de tinción de las muestras cargadas en el buffer. Las muestras corresponden. El marcador de peso molecular es de 100 pb. De igual forma evaluó la eficiencia de ambos colorantes para la tinción de ADN en geles de agarosa, utilizando los protocolos para encontrar genes de resistencia bacteriana respectivamente. Se cargaron 7 µl de cada muestra en los pozos de un gel de agarosa al 1.5%. Se tiñó el gel con gelred, siguiendo los métodos de teñir el gel y tinción de las muestras cargadas en el buffer. Se visualizó el gel en un transiluminador UV y se capturó la imagen con una cámara digital.

Discusión
GelRed® mostró una intensidad de fluorescencia comparable o superior a la del EtBr sin modificar los protocolos de extracción, amplificación y electroforesis. A diferencia del EtBr, GelRed® es más seguro, no presenta toxicidad ni efectos mutagénicos, y no interfiere con enzimas de restricción ni la PCR. La eficiencia y reproducibilidad de GelRed® fueron evaluadas en protocolos para detectar mutaciones hematológicas y genes de resistencia bacteriana, confirmando su idoneidad como alternativa segura y sensible en técnicas de electroforesis, mejorando la seguridad porque estamos minimizando el riesgo de los analistas a la exposición y eficacia en los laboratorios de biología molecular.
Conclusiones
En conclusión, los resultados respaldan la substitución del bromuro de etidio (EtBr) por GelRed® en la tinción de ácidos nucleicos en geles de agarosa. GelRed® mostró una intensidad de fluorescencia comparable o superior a la del EtBr sin necesidad de ajustes en los protocolos, y su seguridad inherente lo posiciona como una opción destacada. Esta transición mejora la seguridad en el laboratorio y optimiza la sensibilidad y estabilidad en las técnicas de electroforesis, contribuyendo significativamente a la eficacia de los procedimientos en biología molecular.
Arbizú Medina, O., Romero Oviedo, F., García Rosales, K., Molina Morales, A. E., García Herrera, F. A., Centeno Rizo, B. R., . . . Amaya, E. (2023). cinetobacter baumannii, multiresistentes a los carbapenémicos a nivel hospitalario. 12(23). doi:DOI: https://doi.org/10.5377/rtu.v12i33.15895.
Hall, A. (2019). A comparison of DNA stains and staining methods for Agarose Gel Electrophoresis. bioRxiv, doi: 10.1101/568253.
Ude, A., Afi-Leslie, K., Okeke, K., & Ogbodo, E. (2022). Trypan Blue Exclusion Assay, Neutral Red, Acridine Orange and Propidium Iodide. In Cytotoxicity. IntechOpen.
Masciotti, V. (2018). Design of an environment-indipendent, tunable 3D DNA-origami plasmonic sensor.
Debroy, A., Yadav, M., Dhawan, R., Dey, S., & George, N. (2022). DNA dyes: toxicity, remediation strategies and alternatives. Folia Microbiologica, 67(4), 555-571.
Haines, A. M., Tobe, S. S., Kobus, H. J., & Linacre, A. (2015). Effect of nucleic acid binding dyes on DNA extraction, amplification, and STR typing. Electrophoresis, 36(20), 2561-2568.
Vílchez, G., & Alonso, G. (2009). Alcances y limitaciones de los métodos de epidemiología molecular basados en el análisis de ácidos nucleicos. Revista de la Sociedad Venezolana de microbiología, 29(1), 6-12.